题目内容
【题目】有下列转化关系(反应条件略):

已知:① X 、Y 、Z 、W 均为氧化物。常态下,X 是红棕色气体;Y 能使澄清石灰水变浑浊但不能使品红溶液褪色。② 相对分子质量:甲﹤乙 。③ 将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请填写下列空白:
(1)Z的化学式: 。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,反映出乙的浓溶液具有 性。利用这种性质可以进行 项(填字母)实验操作。
a.钝化铁片 b.检验Ba2+离子 c.干燥氨气 d.干燥氯气
(3)在 X 和 Z 的反应中,被氧化的X 与被还原的X 的物质的量之比是: 。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2 ,写出该反应的离子方程式: 。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式: 。
【答案】(1)H2O;(2)吸水;d;(3)2:1;
(4)SO2+Br2+2H2O=H2SO4+2HBr;
(5)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
试题分析:X、Y、Z、W均为氧化物,常态下,X是红棕色气体,则X为NO2;Y能使澄清石灰水变浑浊但不能使品红溶液褪色,则Y为CO2;甲与M反应得到二氧化氮、二氧化碳,可推知甲为HNO3、M为碳,乙与碳反应得到二氧化碳、二氧化硫,可推知乙为H2SO4,故Z为H2O,W是二氧化硫。
(1)由上述分析可知,Z为H2O;
(2)浓硫酸具有吸水性,露置在空气中一段时间,其质量增加浓度降低,可以用于干燥氯气,硫酸能与氨气反应,不能干燥氨气,浓硫酸具有强氧化性,可以使Fe片钝化,利用硫酸根检验Ba2+离子;
(3)X和Z的反应为3NO2+H2O=2HNO3+NO,被氧化的二氧化氮生成HNO3,被还有的二氧化氮生成NO,由方程式可知,被氧化的NO2与被还原的NO2的物质的量之比是2:1;
(4)溴具有强氧化性,在溶液中将二氧化硫氧化为硫酸,自身被还原为HBr,反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr,由于生成强酸,在工业生产带来了强酸对设备腐蚀问题;
(5)碳与浓硝酸在加热条件下生成二氧化碳、二氧化氮与水,反应方程式为:C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O。
CO2↑ + 4NO2↑ + 2H2O。

【题目】欲制取较纯净的1,2﹣二氯乙烷,可采取的方法是( )
A.乙烯与氯化氢加成
B.乙烯与氯气加成
C.乙烷与氯气以1:2的体积比在光照条件下反应
D.乙烯先与氯化氢加成,再与等物质的量的氯气在光照下反应
【题目】
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
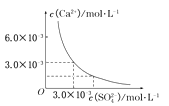
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度![]() )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
![]()
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
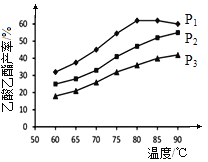
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。