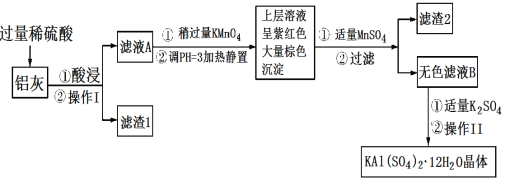
题目内容
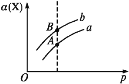
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)
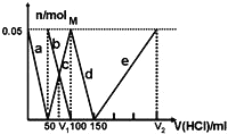
A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
【答案】D
【解析】A、根据H2CO3和Al(OH)3的电离平衡常数,得H+能力大小:AlO2->CO32->HCO3-,滴加盐酸发生:AlO2-+H++H2O=Al(OH)3↓,继续滴加盐酸发生CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O、Al(OH)3+3H+=Al3++3H2O,因此a曲线表示的是AlO2-+H++H2O=Al(OH)3↓,故A错误;B、根据图像,M点是CO32-完全转化成HCO3-,即发生CO32-+H+=HCO3-,没有CO2产生,故B错误;C、根据A选项分析,a线发生AlO2-+H++H2O=Al(OH)3↓,AlO2-全部转化成Al(OH)3,消耗H+的物质的量50×10-3×1mol=0.05mol,则n(AlO2-)=0.05mol,b线发生CO32-+H+=HCO3-,CO32-全部转化成HCO3-,消耗H+的物质的量为(100-50)×10-3×1mol=0.05mol,则n(CO32-)=0.05mol,原溶液中CO32-和AlO2-的物质的量之比为0.05:0.05=1:1,故C错误;D、当加入V1mL盐酸时,溶液中n(HCO3-)=n(CO32-)=0.025mol,因此共消耗盐酸的体积为V1=(0.05+0.025)×1000/1mL=75mL,当盐酸体积为V2时,溶液中溶质为NaCl和AlCl3,根据元素守恒,因此n(HCl)=n(Na+)+3n(Al3+)=[0.05×2+0.05+3×0.05]mol=0.3mol,则V2=0.3×1000/1mL=300mL,因此V1:V2=75:300=1:4,故D正确。