题目内容
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)写出D在元素周期表中的位置为___________________ ,其三价阳离子的价层电子排布图为___________________ ;
(2)F元素位于元素周期表_________区,其基态原子有_________种能量不同的电子;
(3)第二周期中基态原子未成对电子数与E相同且电负性较大的元素为___________(写元素符号);
(4)E单质可作邻硝基苯酚或对硝基苯酚与H2加成的催化剂。邻硝基苯酚和对硝基苯酚在20![]() 水中的溶解度之比为0.39,其原因为___________________;
水中的溶解度之比为0.39,其原因为___________________;
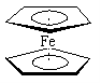
(5)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。黄血盐的内界是_____(写出化学式),黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与黄血盐的配体互为等电子体的气态化合物,写出该气态化合物的电子式__________;
(6)E2+与Mg2+、O2﹣形成晶体的晶胞结构如下左图所示(E2+未画出),则该晶体的化学式为__.


(7)金属C、F晶体的晶胞结构如上图Ⅰ、Ⅱ(请先判断对应的图),金属F的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA, F原子的摩尔质量为M g/mol,则表示F原子半径的计算式为______________pm(列出算式即可,不必化简)。
【答案】第4 周期VIII 族![]() ds7O邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度[Fe(CN)6]4-
ds7O邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度[Fe(CN)6]4-![]() Mg2NiO3
Mg2NiO3![]()
![]() ×1010pm
×1010pm
【解析】
A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,A是形成化合物种类最多的元素,则A为碳元素;A、B属于同一短周期元素且相邻,则B为氮元素;C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,则C是钾元素,其价层电子排布为4S1;F是铜元素,其价层电子排布为3d104S1;基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,则D是铁元素,其价层电子排布为3d64S2;E为镍元素,其价层电子排布为3d84S2,据此分析可得结论。
(1)D为铁元素,在周期表的位置为第4 周期VIII 族,在形成三价阳离子时不仅失去4s轨道上的2个电子,3d轨道上也失去一个电子,达到半满状态,其价层电子排布图为![]() ;
;
(2)F为铜元素,位于周期表中的ds区,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1,有7种能量不同的原子,故答案为:ds、7;
(3)第二周期中基态原子未成对电子数与E相同的原子有C和O,电负性较大的为氧,故答案为:O;
(4)邻硝基苯酚分子中硝基上的氧原子易与酚羟基上的氢原子形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度,故答案为:邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度;
(5)根据信息可得黄血盐的化学式:K4[Fe(CN)6],外界为K+,内界为:[Fe(CN)6]4-;黄血盐溶液与稀硫酸加热时发生非氧化还原反应,说明元素化合价不变,生成硫酸盐和一种与CN-是等电子体的气态化合物,根据元素守恒知该气态化合物是CO,其电子式与氮气类似,形成碳氧叁键,故答案为:[Fe(CN)6]4- 、![]() ;
;
(6)氧离子位于该晶胞的棱上,氧离子个数=![]() ×12=3,所以该晶胞含有3个氧离子;镁离子处在面上,镁离子个数=
×12=3,所以该晶胞含有3个氧离子;镁离子处在面上,镁离子个数=![]() ×4=2,该晶胞中含有2个镁离子,根据化学式中元素化合价代数和为零,该晶胞中含有1个Ni2+,所以该晶胞的化学式为Mg2NiO3,故答案为:Mg2NiO3;
×4=2,该晶胞中含有2个镁离子,根据化学式中元素化合价代数和为零,该晶胞中含有1个Ni2+,所以该晶胞的化学式为Mg2NiO3,故答案为:Mg2NiO3;
(7)钾晶体为体心立方堆积,铜晶体为面心立方堆积,故Ⅰ是钾晶胞,Ⅱ是铜晶胞;此晶胞含有的铜原子为:8×![]() +6×
+6×![]() =4,由密度公式先求出晶胞的体积
=4,由密度公式先求出晶胞的体积![]() cm3,再算出棱长
cm3,再算出棱长![]() cm,最后面对角线
cm,最后面对角线![]() 为原子半径,则原子半径的计算式为
为原子半径,则原子半径的计算式为![]()
![]() cm=
cm=![]()
![]() ×1010pm,故答案为:
×1010pm,故答案为:![]()
![]() ×1010pm
×1010pm

【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____个,化合物乙中采取sp3方式杂化的原子对应元素的电负性由大到小的顺序为_____。
(3)某含Ti3+配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配合物离子中含有的化学键类型是_____,1 mol该配合物中含有的σ键数目是_____。
(4)通过x-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_____。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.469 nm,c=0.295 nm,则该钛晶体的密度为______g·cm-3(用NA 表示阿伏加德罗常数的值,列出计算式即可)。