��Ŀ����
����Ŀ��̼�ǵ���������������������Ԫ��֮һ������Ҫ��ش���������:
��1��̼ԭ�ӵļ۵����Ų�ͼ��________________��������______�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2��̼�����γɶ����л��������ͼ��ʾ��һ�����ʺ�һ����वĽṹ�����ַ���������ԭ�Ӷ���һ��ƽ���ϡ�

������������Ԫ�صĵ縺���ɴ�С��˳��______________________��
�������й��֮��ļнǡ�1�ȡ�2����ԭ��_________________________________��
����ऽṹ��N ԭ�ӵ��ӻ���ʽ___________��
�ܷ����еĴ�м������÷���![]() ��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ
��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ![]() )�������ʺ�����ж����д�м������ʸ�����еĴ�м���ʾΪ______________��
)�������ʺ�����ж����д�м������ʸ�����еĴ�м���ʾΪ______________��
��3��̼���γ�CO��CO2��H2CO3�ȶ����������
���ڷ�ӦCO ת����CO2 �Ĺ����У�����˵����ȷ����__________��
A��ÿ�������й¶Ե��������� B�����Ӽ��Ա仯
C��ԭ�Ӽ�ɼ���ʽ�ı� D�����ӵ��۷е���
�ڸɱ��ͱ������ֳ����ķ��Ӿ��壬�����еĿռ������ʣ��ɱ�_______����(�>���� ��<����=��)
��H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��___________��
��4����2017 �꣬�����ѧ���Ŷӹ�ͬ�ϳ���̼��һ������ͬ�������壺 T- ̼��T- ̼�Ľṹ�ǣ����������ʯ�е�ÿ��̼ԭ����һ����4 ��̼ԭ����ɵ���������ṹ��Ԫȡ�����γ�̼��һ��������ά��������ṹ������ͼ����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶȵı���ʽΪ______________g/cm3��

���𰸡�![]() 6N>C>H����N C H���µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij������������Ǵ�sp3
6N>C>H����N C H���µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij������������Ǵ�sp3![]() BCD>��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ���
BCD>��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ���![]()
��������
��1��̼Ϊ6��Ԫ�أ�̼ԭ�ӵļ۵����Ų�ͼΪ��![]() ��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ���2����Ԫ�صķǽ�����Խǿ���縺����ֵԽ������������Ԫ�صĵ縺���ɴ�С��˳��ΪN > C > H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij���������Խ����Խ����������й��֮��ļнǡ�1�ȡ�2����ऽṹ��N ԭ��������3��ԭ�ӣ�����1���¶Ե��ӣ�����sp3�ӻ����ܷ����еĴ�м������÷���
��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ���2����Ԫ�صķǽ�����Խǿ���縺����ֵԽ������������Ԫ�صĵ縺���ɴ�С��˳��ΪN > C > H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij���������Խ����Խ����������й��֮��ļнǡ�1�ȡ�2����ऽṹ��N ԭ��������3��ԭ�ӣ�����1���¶Ե��ӣ�����sp3�ӻ����ܷ����еĴ�м������÷���![]() ��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�������������वĽṹ�����еĴ�м���5��ԭ��6�������γɵı�ʾΪ
��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�������������वĽṹ�����еĴ�м���5��ԭ��6�������γɵı�ʾΪ![]() �� ��3����A��CO������̼�����ϸ���1���¶Ե��ӣ�CO2������̼�����ϸ���2���¶Ե��ӣ�ѡ��A���� B��COΪ���Է��ӣ�CO2Ϊ�Ǽ��Է��ӣ����Ӽ��Ա仯��ѡ��B��ȷ��C��CO�д���̼��������CO2�д���̼��˫����������ԭ�Ӽ�ɼ���ʽ�ı䣬ѡ��C��ȷ��D����Ӧ���е�һ����̼����������Է�������С�������������̼�����ӵ��۷е���ѡ��D��ȷ����ѡBCD����ˮ���Ӽ���������������з����ԣ�����ˮ�����γɱ�ʱ���ڽϴ�Ŀ�϶���ɱ�����֮��ֻ���ڷ��»������γɵķ��Ӿ������ܶѻ��������еĿռ������ʣ��ɱ�>��������������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ�������ˮ���������������ܹ���ȫ��Ӧ�������ᣬ�ʴ�Ϊ��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ���4�����ݾ����ṹͼ�������к��е���������ṹ����Ŀ=
�� ��3����A��CO������̼�����ϸ���1���¶Ե��ӣ�CO2������̼�����ϸ���2���¶Ե��ӣ�ѡ��A���� B��COΪ���Է��ӣ�CO2Ϊ�Ǽ��Է��ӣ����Ӽ��Ա仯��ѡ��B��ȷ��C��CO�д���̼��������CO2�д���̼��˫����������ԭ�Ӽ�ɼ���ʽ�ı䣬ѡ��C��ȷ��D����Ӧ���е�һ����̼����������Է�������С�������������̼�����ӵ��۷е���ѡ��D��ȷ����ѡBCD����ˮ���Ӽ���������������з����ԣ�����ˮ�����γɱ�ʱ���ڽϴ�Ŀ�϶���ɱ�����֮��ֻ���ڷ��»������γɵķ��Ӿ������ܶѻ��������еĿռ������ʣ��ɱ�>��������������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ�������ˮ���������������ܹ���ȫ��Ӧ�������ᣬ�ʴ�Ϊ��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ���4�����ݾ����ṹͼ�������к��е���������ṹ����Ŀ=![]() ��ÿ����������ṹ����4��̼ԭ�ӣ�����������=
��ÿ����������ṹ����4��̼ԭ�ӣ�����������=![]() ����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶ�Ϊ
����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶ�Ϊ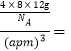
![]() g/cm3��
g/cm3��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�