题目内容
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____个,化合物乙中采取sp3方式杂化的原子对应元素的电负性由大到小的顺序为_____。
(3)某含Ti3+配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配合物离子中含有的化学键类型是_____,1 mol该配合物中含有的σ键数目是_____。
(4)通过x-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_____。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.469 nm,c=0.295 nm,则该钛晶体的密度为______g·cm-3(用NA 表示阿伏加德罗常数的值,列出计算式即可)。

【答案】 3d24s2 7 O>N>C 配位键、极性共价键 18 NA TiN>MgO>CaO>KCl 
【解析】试题分析:(1)Ti是22号元素,原子核外有22个电子,3d、4s是其外围电子,根据核外电子排布规律写价电子排布式;(2)化合物甲的分子中采取sp2方式杂化的碳原子价电子对数是3;化合物乙中采取sp3方式杂化的原子有C、N、O,同周期元素电负性逐渐增大;(3) [TiCl(H2O)5]Cl2·H2O配合离子是[TiCl(H2O)5]2+,该离子的配位体是Cl-和H2O;单键是σ键、双键、三键中各有1个σ键;(4)离子带的电荷越多,晶格能越大,离子半径越小晶格能越大,晶格能越大晶体沸点越高;(5)根据均摊法,该晶胞含有的原子数是![]() ,一个晶胞的体积是
,一个晶胞的体积是![]() ;
;
解析:(1)Ti是22号元素,原子核外有22个电子,3d、4s是其外围电子,根据核外电子排布规律,价电子排布式3d24s2;(2)化合物甲的分子中采取sp2方式杂化的碳原子价电子对数是3,苯环上的碳原子、羰基上的碳原子都是sp2方式杂化,共7个;化合物乙中采取sp3方式杂化的原子有C、N、O,同周期元素电负性逐渐增大,所以电负性由大到小的顺序为O>N>C;(3) [TiCl(H2O)5]Cl2·H2O配合离子是[TiCl(H2O)5]2+,该离子的配位体是Cl-和H2O,含有的化学键类型是配位键、极性共价键;单键是σ键、双键、三键中各有1个σ键,1 mol该配合物中含有的σ键数目是18NA;(4)离子带的电荷越多,晶格能越大,离子半径越小晶格能越大,晶体沸点越高,所以晶体熔点由高到低的顺序为TiN>MgO>CaO>KCl;(5)根据均摊法,该晶胞含有的原子数是![]() ,一个晶胞的体积是
,一个晶胞的体积是![]() ;所以密度是
;所以密度是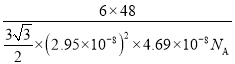 。
。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案