题目内容
【题目】在0.01mol·L-1 的醋酸溶液中逐渐加入冰醋酸至1mol·L-1,随着浓度的增加,在一定时间内始终保持减小趋势的是
A. c(H+) B. c(CH3COO-)
C. c(H+)/c(CH3COOH)的比值 D. c(CH3COOH)/c(H+)的比值
【答案】C
【解析】醋酸溶液中存在CH3COOH![]() CH3COO-+ H+,加入冰醋酸,浓度增大,电离程度减小。A、加入冰醋酸,浓度增大,酸的浓度增大,c(H+)增大,选项A错误;B、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,选项B错误;C、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,而温度不变,K=
CH3COO-+ H+,加入冰醋酸,浓度增大,电离程度减小。A、加入冰醋酸,浓度增大,酸的浓度增大,c(H+)增大,选项A错误;B、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,选项B错误;C、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,而温度不变,K= 不变,故
不变,故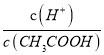 减小,选项C正确;D、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,而温度不变,K=
减小,选项C正确;D、加入冰醋酸,浓度增大,酸的浓度增大,c(CH3COO-)增大,而温度不变,K=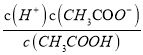 不变,故
不变,故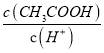 增大,选项D错误。答案选C。
增大,选项D错误。答案选C。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环,有效降低碳排放。
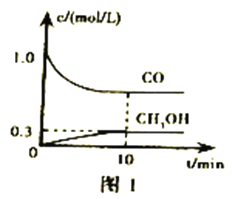
(1)在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
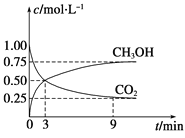
①计算:从0min到3min,H2的平均反应速率v(H2)=_______mol·L-1·min-1,反应至平衡时,放出的热量是_______kJ。
②能说明上述反应达到平衡状态的是________(填编号)。
A.c(CO2) ∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)已知A(g)+B(g) ![]() C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | x | 0.6 | 0.4 |
回答下列问题:
①该反应是_____反应(填“放热”或“吸热”)。
②830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=____。
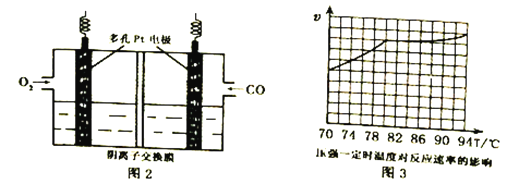
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
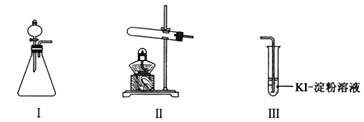
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。