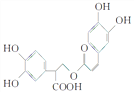
题目内容
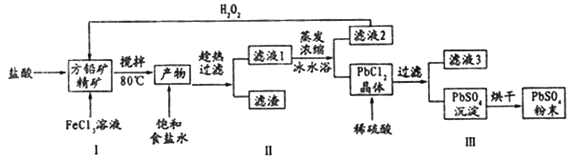
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
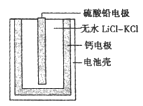
①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
【答案】 PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓ 冰水浴可以使吸热反戍PbCl2(s)十2Cl-(aq)![]() PbCl4-(aq)逆向移动。PbCl4-不断转化为PbCl2晶体而析出 FeCl3和盐酸 PbCl2(s)+SO42-(aq)
PbCl4-(aq)逆向移动。PbCl4-不断转化为PbCl2晶体而析出 FeCl3和盐酸 PbCl2(s)+SO42-(aq) ![]() PbSO4(s) +2Cl-(aq) B 正极 Ca+2Cl--2e-=CaCl2 20.7
PbSO4(s) +2Cl-(aq) B 正极 Ca+2Cl--2e-=CaCl2 20.7
【解析】(1)本题考查氧化还原反应方程式的书写,淡黄色的沉淀是S,方铅矿中加入盐酸和FeCl3,FeCl3具有强氧化性,把-2价S氧化成S,且PbCl2属于难溶物,因此离子反应方程式为:PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓;(2)考查勒夏特列原理,产物中加入NaCl,发生PbCl2+2Cl-![]() PbCl42-,此反应是吸热反应,采用冰水浴,促使平衡向正反应方向进行,生成PbCl2;(3)考查对流程的分析,滤液2中加入H2O2,H2O2把Fe2+氧化成Fe3+,FeCl3可以循环使用,PbCl2中加入稀硫酸,发生PCl2+H2SO4=PbSO4+2HCl,盐酸可以循环使用;(4)考查沉淀的转化,PbCl2和PbSO4都难溶于水,且PbSO4比PbCl2更难溶,离子反应方程式为PbCl2(s)+SO42-(aq)
PbCl42-,此反应是吸热反应,采用冰水浴,促使平衡向正反应方向进行,生成PbCl2;(3)考查对流程的分析,滤液2中加入H2O2,H2O2把Fe2+氧化成Fe3+,FeCl3可以循环使用,PbCl2中加入稀硫酸,发生PCl2+H2SO4=PbSO4+2HCl,盐酸可以循环使用;(4)考查沉淀的转化,PbCl2和PbSO4都难溶于水,且PbSO4比PbCl2更难溶,离子反应方程式为PbCl2(s)+SO42-(aq) ![]() PbSO4(s) +2Cl-(aq);(5)根据反应方程式,Pb以Pb2+形式参与反应,pH过小,平衡向逆反应方向进行,pH过大,以Pb(OH)2全部沉淀,因此pH控制在6~7之间,故选项B正确;(6)考查电极反应式的书写和原电池的工作原理,①根据原电池的工作原理,阳离子向正极移动,即Li+向正极移动;②负极是失去电子,化合价升高的反应,Ca在负极上反应,电极反应式为Ca+2Cl--2e-=CaCl2;③PbSO4失去2mol电子转变成Pb,因此转移0.2mol电子生成Pb的质量为207×2/0.2g=20.7g。
PbSO4(s) +2Cl-(aq);(5)根据反应方程式,Pb以Pb2+形式参与反应,pH过小,平衡向逆反应方向进行,pH过大,以Pb(OH)2全部沉淀,因此pH控制在6~7之间,故选项B正确;(6)考查电极反应式的书写和原电池的工作原理,①根据原电池的工作原理,阳离子向正极移动,即Li+向正极移动;②负极是失去电子,化合价升高的反应,Ca在负极上反应,电极反应式为Ca+2Cl--2e-=CaCl2;③PbSO4失去2mol电子转变成Pb,因此转移0.2mol电子生成Pb的质量为207×2/0.2g=20.7g。