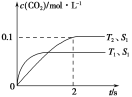
题目内容
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。

图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) _____________________。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
(3)检验乙醇氧化产物时F中的实验现象是____________________________。
(4)E处是一种纯净物,其反应方程式为_______________________________________。
(5)写出乙醇发生催化氧化的化学方程式_______________________________________。
【答案】 E A B F 水浴加热 有砖红色沉淀生成 2KMnO4 ![]() K2MnO4+ MnO2+O2↑ 2CH3CH2OH + O2
K2MnO4+ MnO2+O2↑ 2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
【解析】(1)固体加热制氧气需要加热,乙醇变为蒸汽需加热,乙醇的催化氧化要加热,醛和氧气的反应也要加热,故答案为:E、A、B、F;
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热;故答案为:水浴加热;
(3)乙醛能和氢氧化铜悬浊液反应,生成砖红色沉淀,所以F中会产生红色沉淀,故答案为:F中产生红色沉淀;
(4)固体纯净物加热制氧气的只能是加热高锰酸钾制氧气,反应为:2KMnO4![]() K2MnO4+MnO2+O2↑,故答案为:2KMnO4
K2MnO4+MnO2+O2↑,故答案为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(5)乙醇发生催化氧化的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。

【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:

已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。