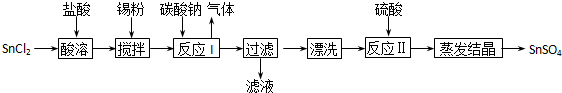
题目内容
4.高铁酸钾(K2FeO4)是一种集氧化、吸附、始凝于一体的新型多功能水处理剂.其生产工艺如下: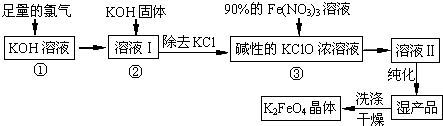
已知:
①2KOH+Cl2=KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在温度较低(填“温度较高”或“温度较低”)的情况下进行;写出工业上制取Cl2的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(2)K2FeO4可作为新型多功能水处理剂的原因+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(3)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为10mol/L;
(4)在“反应液Ⅰ”中加KOH固体的目的是①与“反应液I”中过量的Cl2继续反应,生成更多的KClO②为下一步反应提供反应物;
(5)从“反应液Ⅱ”中分离出K2FeO4后,副产品是KNO3、KCl(写化学式).
分析 足量氯气通入氢氧化钾溶液中低温反应生成次氯酸钾、氯化钾和水,加入固体氢氧化钾除去氯化钾得到减小次氯酸钾浓溶液,加入硝酸铁浓溶液纯化洗涤干燥得到高铁酸钾晶体;
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3;工业是利用电解饱和食盐水制取氯气;
(2)K2FeO4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(3)根据n=$\frac{m}{M}$计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=$\frac{m}{p}$计算溶液体积,再根据c=$\frac{n}{V}$计算氢氧化钾溶液的物质的量浓度;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(5)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.
解答 解:(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:温度较低;2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉,
故答案为:+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(3)61.6g KOH固体的物质的量为$\frac{61.6g}{56g/mol}$=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为$\frac{161.6g}{1.47×1{0}^{-3}g/L}$=$\frac{161.6}{1470}$L,所以氢氧化钾溶液的物质的量浓度为$\frac{1.1mol}{\frac{161.6}{1470}L}$=10mol/L,
故答案为:10mol/L;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.为下一步反应提供反应物,
故答案为:与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物;
(5)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl,
故答案为:KNO3、KCl.
点评 本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.

| A. | Cl2+H2O═HCl+HClO | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | CaO+H2O═Ca(OH)2 |
| A. | 甲与乙所含离子种数完全相同 | B. | 甲与乙所含离子种类完全不同 | ||
| C. | 甲与乙可能含有2种相同的离子 | D. | 甲与乙的颜色一定相同 |
| A. | Al2O3→Al(OH)3 | B. | KNO3→KOH | C. | Zn→ZnCl2 | D. | MgCl2→Mg(OH)2 |
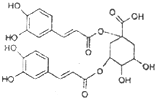 洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A的结构如图.下列关于A的相关叙述正确的是( )
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A的结构如图.下列关于A的相关叙述正确的是( )| A. | A在酸性条件下可以发生水解反应 | |
| B. | 1mol A和足量NaOH溶液反应,最多消耗9molNaOH | |
| C. | A能和浓溴水发生加成和取代反应 | |
| D. | 不能与新制得Cu(OH)2反应但能与FeCl3发生显色反应 |
| A. | 1L 1mol•L-1的两种强酸溶液中,所含氢离子数目均为NA | |
| B. | T℃时,1 L pH=6纯水中,含10-6NA个OH- | |
| C. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- | |
| D. | 标准状况下22.4LHCl气体溶于水,其溶液中H+数为NA |