题目内容
16.由两种盐组成的白色粉末混合物,加热时无气体逸出.其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色.取此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊.在上述粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成.试推断该混合物的可能组成.分析 其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色,则两种盐分别含Na、K元素;此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊,则一定有一种碳酸盐,粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成,白色沉淀为AgCl,则一定含一种盐酸盐,以此来解答.
解答 解:由两种盐组成的白色粉末混合物,其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色,则两种盐分别含Na、K元素;加热时无气体逸出,此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊,则一定有一种碳酸盐,粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成,白色沉淀为AgCl,则一定含一种盐酸盐,可知混合物由KCl、Na2CO3或NaCl、K2CO3组成,
答:该混合物的可能组成为KCl、Na2CO3或NaCl、K2CO3.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、反应与现象推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
4.下列关于工业生产的叙述中,不正确的是( )
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
11.若要配制480mL0.1mol/L的硫酸铜溶液,以下操作正确的是( )
| A. | 称取7.68g硫酸铜,加入500mL水 | B. | 称取12.5g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.0g胆矾配成500mL溶液 |
1.“低钠盐”可以控制钠的摄入量从而防治高血压等疾病.制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl.国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2).
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是Cl-(填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是Cl-(填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品b于烧杯中,加足量蒸馏水,并用玻璃棒搅拌 | 样品溶解,形成无色溶液. |
| 步骤2:取少量步骤1形成的溶液于试管中,再滴加少量NaOH溶液,振荡 | 有白色沉淀生成,说明样品b中添加了镁盐 |
| 步骤3:取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液振荡 | 若有白色沉淀产生,则添加的是MgSO4.若无明显现象,则添加的是MgCl2 |
8.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
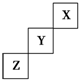

| A. | X、Y、Z三种元素中,与H2化合最容易的是X元素 | |
| B. | 最高价氧化物对应的水化物的酸性:Y>Z | |
| C. | Y的最高正化合价为+7价 | |
| D. | X单质的熔点比Z的低 |
5.下列物质中,不属于电解质的是( )
| A. | NaCl | B. | 盐酸 | C. | H2SO4 | D. | KOH |
 ;
;