题目内容
C和Si元素在化学中占有极其重要的地位.(1)写出Si的基态原子核外电子排布式______.从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______.
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______,微粒间存在的作用力是______.
(3)氧化物MO的电子总数与SiC的相等,则M为______(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是______.
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健______.
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是______,B的结构式是______.
(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出______kJ的热量.
【答案】分析:(1)Si原子核外共14个电子,按照能量最低原则书写电子排布式;元素周期表中主族元素越靠右、越靠上电负性越大,F的电负性最大(为4.0);
(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3;非金属原子之间形成的化学键为共价键;
(3)根据电子总数判断M的原子序数,进而确定元素符号;从影响离子晶体熔沸点高低的因素分析二者熔沸点的高低;
(4)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键,则A分子为同种元素形成的分子,所以A是氮气;B的分子也属于非极性分子,但既有非极性键,又有极性键,B为乙炔;C的分子属于极性分子,C是CO;
(6)1mol晶体硅中含有1mol×4× =2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,据此计算.
=2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,据此计算.
解答:解:(1)Si是14号元素,Si原子核外共14个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道;其电子排布式为:1s22s22p63s23p2;从电负性的角度分析,O和C位于同一周期,非金属性O强于C;C和Si为与同一主族,C的非金属性强于Si,故由强到弱为O>C>Si,
故答案为;1s22s22p63s23p2; O>C>Si;
(2)SiC中Si和C原子均形成四个单键,故其为sp3杂化;非金属原子之间形成的化学键全部是共价键,
故答案为:sp3;共价键;
(3)MO和SiC的电子总数相等,故含有的电子数为20,则M含有12个电子,即Mg;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高;故答案为:Mg;Mg2+半径比Ca2+小,MgO晶格能大;
(4)CO2晶体是分子晶体,其中C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,
故答案为:Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键,则A分子为同种元素形成的分子,所以A是氮气;B的分子也属于非极性分子,但既有非极性键,又有极性键,B为乙炔;C的分子属于极性分子,C是CO,所以A的电子式为 ,B的结构式为:H-C≡C-H,
,B的结构式为:H-C≡C-H,
故答案为: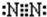 ,H-C≡C-H;
,H-C≡C-H;
(6)1mol晶体硅中含有1mol×4× =2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+497.3kJ/mol-460kJ/mol×4=-990.7 kJ/mol,
=2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+497.3kJ/mol-460kJ/mol×4=-990.7 kJ/mol,
故答案为:-990.7.
点评:考查键能与反应热的关系、电子式、结构式、核外电子排布式的书写等知识点,注意1mol晶体硅中Si-Si键、1mol二氧化硅晶体中Si-O键的物质的量,为易错点.
(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3;非金属原子之间形成的化学键为共价键;
(3)根据电子总数判断M的原子序数,进而确定元素符号;从影响离子晶体熔沸点高低的因素分析二者熔沸点的高低;
(4)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键,则A分子为同种元素形成的分子,所以A是氮气;B的分子也属于非极性分子,但既有非极性键,又有极性键,B为乙炔;C的分子属于极性分子,C是CO;
(6)1mol晶体硅中含有1mol×4×
 =2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,据此计算.
=2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,据此计算.解答:解:(1)Si是14号元素,Si原子核外共14个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道;其电子排布式为:1s22s22p63s23p2;从电负性的角度分析,O和C位于同一周期,非金属性O强于C;C和Si为与同一主族,C的非金属性强于Si,故由强到弱为O>C>Si,
故答案为;1s22s22p63s23p2; O>C>Si;
(2)SiC中Si和C原子均形成四个单键,故其为sp3杂化;非金属原子之间形成的化学键全部是共价键,
故答案为:sp3;共价键;
(3)MO和SiC的电子总数相等,故含有的电子数为20,则M含有12个电子,即Mg;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高;故答案为:Mg;Mg2+半径比Ca2+小,MgO晶格能大;
(4)CO2晶体是分子晶体,其中C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成稳定的π键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键,
故答案为:Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键,则A分子为同种元素形成的分子,所以A是氮气;B的分子也属于非极性分子,但既有非极性键,又有极性键,B为乙炔;C的分子属于极性分子,C是CO,所以A的电子式为
 ,B的结构式为:H-C≡C-H,
,B的结构式为:H-C≡C-H,故答案为:
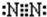 ,H-C≡C-H;
,H-C≡C-H;(6)1mol晶体硅中含有1mol×4×
 =2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+497.3kJ/mol-460kJ/mol×4=-990.7 kJ/mol,
=2molSi-Si键,二氧化硅晶体中每个Si原子形成4个Si-O键,1mol二氧化硅晶体中含有4molSi-O键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+497.3kJ/mol-460kJ/mol×4=-990.7 kJ/mol,故答案为:-990.7.
点评:考查键能与反应热的关系、电子式、结构式、核外电子排布式的书写等知识点,注意1mol晶体硅中Si-Si键、1mol二氧化硅晶体中Si-O键的物质的量,为易错点.

练习册系列答案
相关题目

 www.7caiedu.cn
www.7caiedu.cn C和Si元素在化学中占有极其重要的地位。
C和Si元素在化学中占有极其重要的地位。 键和
键和 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述