题目内容
(2011?松江区模拟)C和Si元素在化学中占有极其重要的地位.
(1)写出Si原子核外最外层电子排布式
(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是
(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显
(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有
(1)写出Si原子核外最外层电子排布式
3s23p2
3s23p2
. C、Si和O元素的原子半径由小到大的顺序为O<C<Si
O<C<Si
.(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是
共价键
共价键
.SiC晶体熔点>
>
晶体硅(填<、>、=).(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显
酸性
酸性
性,相关的离子方程式Mg2++2H2O?Mg(OH)2+2H+
Mg2++2H2O?Mg(OH)2+2H+
.(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有
将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
.(举一例说明)分析:(1)根据原子核外电子排布规律分析;根据元素周期律中原子半径的递变规律分析.
(2)非金属元素之间易形成共价键(铵盐除外),原子晶体的熔点与组成元素的原子半径有关.
(3)先根据等电子体判断M元素,再根据MCl2盐的类型判断其水溶液的酸碱性.
(4)元素的非金属性越强其最高价氧化物的水化物的酸性越强来判断.
(2)非金属元素之间易形成共价键(铵盐除外),原子晶体的熔点与组成元素的原子半径有关.
(3)先根据等电子体判断M元素,再根据MCl2盐的类型判断其水溶液的酸碱性.
(4)元素的非金属性越强其最高价氧化物的水化物的酸性越强来判断.
解答:解:(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;在元素周期律中,同一周期,元素的原子半径随着原子序数的增大而减小,同一周期,元素的原子半径随着原子序数的增大而增大,所以C、Si和O元素的原子半径由小到大的顺序为 O<C<Si.
故答案为:3s23p2; O<C<Si.
(2)非金属元素之间易形成共价键(铵盐除外),所以SiC的晶体结构中微粒间存在的作用力是共价键;碳化硅和硅相似,都是原子晶体,原子晶体的熔点与组成元素的原子半径有关,原子半径越小,熔点越高,SiC晶体中碳原子的原子半径小于硅原子的原子半径,所以碳化硅晶体的熔点大于晶体硅的熔点.
故答案为:共价键;>.
(3)氧化物MO的电子总数与SiC的相等,所以M是镁元素,氯化镁是强酸弱碱盐,所以其水溶液呈酸性;弱离子镁离子能发生水解生成氢氧化镁和氢离子Mg2++2H2O?Mg(OH)2+2H+,导致溶液中氢离子的浓度大于氢氧根离子的浓度,所以溶液呈酸性.
故答案为:酸性;Mg2++2H2O?Mg(OH)2+2H+.
(4)将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
故答案为:将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
故答案为:3s23p2; O<C<Si.
(2)非金属元素之间易形成共价键(铵盐除外),所以SiC的晶体结构中微粒间存在的作用力是共价键;碳化硅和硅相似,都是原子晶体,原子晶体的熔点与组成元素的原子半径有关,原子半径越小,熔点越高,SiC晶体中碳原子的原子半径小于硅原子的原子半径,所以碳化硅晶体的熔点大于晶体硅的熔点.
故答案为:共价键;>.
(3)氧化物MO的电子总数与SiC的相等,所以M是镁元素,氯化镁是强酸弱碱盐,所以其水溶液呈酸性;弱离子镁离子能发生水解生成氢氧化镁和氢离子Mg2++2H2O?Mg(OH)2+2H+,导致溶液中氢离子的浓度大于氢氧根离子的浓度,所以溶液呈酸性.
故答案为:酸性;Mg2++2H2O?Mg(OH)2+2H+.
(4)将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
故答案为:将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
点评:本题以硅元素为载体考查了核外电子排布式、原子晶体的熔点与原子半径的关系、非金属性强弱的比较等知识点,易错题为(4)题,注意化学用语的正确运用.

练习册系列答案
相关题目

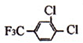 +
+
 +HCl
+HCl A发生缩聚反应
A发生缩聚反应 +nH2O
+nH2O 的含有三氟甲基(F3C一)和苯环的同分异构体共有
的含有三氟甲基(F3C一)和苯环的同分异构体共有