题目内容
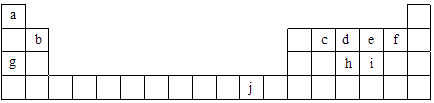
【题目】短周期元素A、B、C、D、E在周期表中的位置如图所示,A、B、C、D位于连续的四个主族,D、E的质子数和是20。
D | |||
A | B | C | E |
回答下列问题:
(1)C元素在周期表中的位置是_______;E元素的名称是_______。
(2)A元素与氧元素形成的原子个数比是1:1的化合物的化学式是_______,该化合物含有的化学键类型是_______。
(3)B原子结构示意图是_______,从原子结构角度分析,B比C活泼性大的原因是_______。
(4)元素D比元素E的非金属性强的理由是_______(用化学方程式表示)。
(5)A、B、C、D离子半径由大到小的顺序是_________(填写离子符号)。
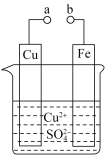
(6)将B、C的单质压成薄片用导线连接后浸入稀硫酸中,能量主要转化方式是_________,正极反应式是_________。
【答案】 第3周期ⅢA族 硅 Na2O2 离子键和共价键 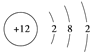 镁原子半径大于铝,镁原子核对最外层电子的吸引力小,容易失去最外层电子 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 O2->Na+>Mg2+>Al3+ 化学能转化为电能 2H++2e-=H2↑
镁原子半径大于铝,镁原子核对最外层电子的吸引力小,容易失去最外层电子 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 O2->Na+>Mg2+>Al3+ 化学能转化为电能 2H++2e-=H2↑
【解析】D、E处于同主族,E的质子数比D多8,D、E的质子数之和为20,则D的质子数为6,E的质子数为14,D为C元素,E为Si元素;A、B、C、D位于连续的四个主族,结合A、B、C、D、E在周期表中的位置,A为Na元素,B为Mg元素,C为Al元素。根据元素周期律和相关化学用语作答。
D、E处于同主族,E的质子数比D多8,D、E的质子数之和为20,则D的质子数为6,E的质子数为14,D为C元素,E为Si元素;A、B、C、D位于连续的四个主族,结合A、B、C、D、E在周期表中的位置,A为Na元素,B为Mg元素,C为Al元素。
(1)C为Al元素,Al原子核外有3个电子层,最外层电子数为3,Al元素在周期表中的位置是第三周期第IIIA族。E为Si元素,名称为硅。
(2)A为Na元素,Na元素与氧元素形成的原子个数比是1:1的化合物的化学式是Na2O2。Na2O2的电子式为![]() ,Na2O2中含有的化学键类型是离子键和共价键。
,Na2O2中含有的化学键类型是离子键和共价键。
(3)B为Mg,Mg的核电荷数为12,Mg原子核外有12个电子,Mg原子结构示意图为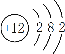 。B(Mg)比C(Al)活泼性大的原因是:镁原子半径大于铝,镁原子核对最外层电子的吸引力小,容易失去最外层电子。
。B(Mg)比C(Al)活泼性大的原因是:镁原子半径大于铝,镁原子核对最外层电子的吸引力小,容易失去最外层电子。
(4)可通过H2CO3(H2CO3为碳元素的最高价含氧酸)的酸性比H2SiO3(H2SiO3为硅元素的最高价含氧酸)的酸性强说明元素D(C)比元素E(Si)的非金属性强,根据“强酸制弱酸”的复分解反应规律,相应的化学方程式为CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓。
(5)A、B、C、D的离子分别是Na+、Mg2+、Al3+、O2-,这四种离子具有相同的电子层结构,根据“序大径小”,四种离子半径由大到小的顺序是O2-![]() Na+
Na+![]() Mg2+
Mg2+![]() Al3+。
Al3+。
(6)将Mg、Al的单质压成薄片用导线连接后浸入稀硫酸中构成原电池,原电池中能量主要转化方式是化学能转化为电能。由于Mg比Al活泼,Mg为负极,Al为正极,负极电极反应式为Mg-2e-=Mg2+,正极电极反应式为2H++2e-=H2↑。