��Ŀ����
����Ŀ���±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء���ش��������⣺
�� | �� | �� | |||||||||||||||
�� | �� | �� | �� | ||||||||||||||
�� | �� | �� |
��1����Ԫ�������ڱ��е�λ���ǵ�______����______�壻
��2���ϱ��١���ʮ��Ԫ���н�������ǿ����______���ǽ�������ǿ����______������Ԫ�ط��ţ�
��3���õ���ʽд������Ԫ�آ�ԭ����Ԫ�آ�ԭ���γɻ�����Ĺ���________________��
��4��д����Ԫ�ص��⻯�����Ԫ�ص��⻯�ﷴӦ�����εĵ���ʽ__________��
��5��д����Ԫ�ص�����������Ӧ��ˮ�����ϡ��Һ�������Ԫ�آᵥ�ʷ�Ӧ�����ӷ���ʽ_________________________________��
��6��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�������������������Ƶ����ʡ���д��Ԫ����������������Ԫ�آ������������Ӧ��ˮ�������Һ��Ӧ�Ļ�ѧ����ʽ��______________________________________________��
���𰸡� �� ��A�� K Cl 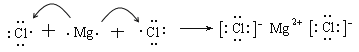
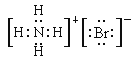 3Fe+8H++2NO3��=3Fe2++2NO��+4H2O 2KOH+Be(OH)2=K2BeO2+2H2O
3Fe+8H++2NO3��=3Fe2++2NO��+4H2O 2KOH+Be(OH)2=K2BeO2+2H2O
������������������Ԫ�������ڱ��е����λ�ã������жϳ��١����Ӧ��Ԫ�����ƣ�Ȼ�����Ԫ�������ɲ��������е������Լ��й����ʵ����ʷ����жϼ��ɡ�
��⣺����Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���Li��Be��N��Mg��Al��Si��Cl��K��Fe��Br����
��1��Ԫ�آ���Si�������ڱ��е�λ���ǵ������ڵڢ�A�壻
��2��ͬ�����������ҽ������������ǽ���������ǿ��ͬ������ϵ��½���������ǿ���ǽ���������������ϱ��١���ʮ��Ԫ���н�������ǿ����K���ǽ�������ǿ����Cl��
��3��Ԫ�آ�ԭ����Ԫ�آ�ԭ���γɵĻ����������ӻ������Ȼ�þ�����γɹ��̿ɱ�ʾΪ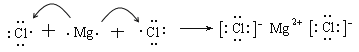 ��
��
��4����Ԫ�ص��⻯�ﰱ�����Ԫ�ص��⻯���廯�ⷴӦ���ɵ������廯泥��������ӻ��������ʽΪ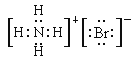 ��
��
��5����Ԫ�ص�����������Ӧ��ˮ�����ϡ��Һ��ϡ���ᣬ����ǿ�����ԣ��������Ԫ�آ�ĵ�������Ӧ��������������NO��ˮ����Ӧ�����ӷ���ʽΪ3Fe+8H++2NO3��=3Fe2++2NO��+4H2O��
��6����Ԫ������Ԫ�ص��������������Ƶ����ʣ���˸��������������������ط�Ӧ��ԭ����֪�������������������ط�Ӧ�Ļ�ѧ����ʽΪ2KOH+Be(OH)2=K2BeO2+2H2O��

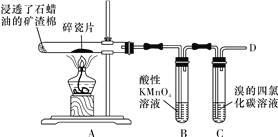
 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�����Ŀ�����й��ڴ������������ʡ��ǵ���ʵ���ȷ���Ϊ(����)
������ | ����� | ����� | �ǵ���� | |
A | ���� | ˮú�� | ���� | �ɱ� |
B | ����ˮ | ������Һ | �Ȼ��� | �������� |
C | ���� | ���� | �� | ̼��� |
D | ���� | ˮú�� | �Ȼ�ͭ | ̼���� |
A. A B. B C. C D. D