题目内容
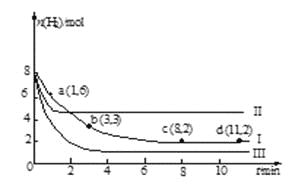
【题目】常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
【答案】AC
【解析】
试题分析:A、a点为(NH4)2SO4溶液,NH4+水解溶液呈酸性,正确;B、b点溶液中还含有SO42-,电荷不守恒,错误;C、c点溶液为等量的NH3·H2O、(NH4)2SO4和Na2SO4溶液,由电荷守衡和物料守恒相减得到,正确;D、d点为NH3·H2O和Na2SO4,关系式为c(NH3·H2O )>c(SO42-)>c(OH-)>c(NH4+),错误。

【题目】下表为八种短周期主族元素的部分性质(已知铍的原子半径为0.89×10-10m):
元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径/10-10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
主要化合价 | -2 | +5、-3 | +4、-4 | +7、-1 | +1 | +3 | +5、-3 | |
其它 | 原子核内无中子 | 无机非金属材料主角 | 有两种氧化物 |
(1)元素M在元素周期表中的位置为_________________________。
(2)写出X、Y、J三种元素形成的化合物电子式_________。用电子式表示X元素与Z元素形成化合物的过程:_______________________。
(3)写出Y与Q两种元素形成的化合物与J的最高价氧化物的水化物反应的离子方程式_____。
(4)R与T相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是_______(填字母)。
A.常温下T的单质呈固态,R的单质呈气态
B.R的氢化物比T的氢化物稳定
C.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
D.R与T形成的化合物中T呈正价
(5)J与Q相比,金属性较强的是____(用元素符号表示),能证明这一结论的依据是______。
(6)根据表中数据推测,M的原子半径的最小范围是 ____________________。