��Ŀ����
��12�֣���ˮ��������ʱ������˫���꣨H2Dz����Ԫ���ᣩ�ѽ���������ϳɵ����Ե����ʣ�����CCl4��ȡ�����Ӷ��ѽ������Ӵ�ˮ��Һ����ȫ�������������˫���꣨H2Dz����CCl4������ˮ�е�Cu2��ʱ���ȷ�����Ϸ�Ӧ��
Cu2��+2 H2DzCu(HDz)2+2H����
�ټ���CCl4��Cu(HDz)2�ͺ����ױ���ȡ��CCl4�С�
��1��д��˫�����Fe3����ϵ����ӷ���ʽ�� ����ȡ������Ҫ�������˵���ȡ������Һ��pH���������� ��
��ͼ����˫���꣨H2Dz����CCl4�����ȡijЩ�������ӵ�������ߡ�����ӳ����ȡijЩ��������ʱ���˵�pH��Χ��E%��ʾij�ֽ����������������ʽ����ȡ����İٷ��ʡ�
ij��ҵ��ˮ�к���Hg2����Bi3+��Zn2+����˫���꣨H2Dz����CCl4�����ȡ��������ˮ��
�������ͼ�ش����⣺
��2������ȫ����ˮ�е�Hg2������������������ҺpH=
��3��������pH=2ʱ���飨Bi���Ĵ�����ʽ�У� �������ʵ���֮��Ϊ
��4����ȡ��CCl4�е�Zn(HDz)2��Һ����������NaOH��Һ�������п��ת��ˮ��Һ�С�д����Ӧ�����ӷ���ʽ��
��1��Fe3+��3H2DzFe(HDz)3��3H+ ��Fe3+ ���γ�Fe(OH)3����
��2��1 ��3��Bi3+ Bi(HDz)3 �� 2: 3 ��4��Zn(HDz)2 + 6OH- = Zn(OH)4-+ 2Dz2- + 2H2O
����:��

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�


 Cu (HDZ)2+2H+���ټ���CCl4
��Cu (HDZ)2�ͺ����ױ���ȡ��CCl4�С�
Cu (HDZ)2+2H+���ټ���CCl4
��Cu (HDZ)2�ͺ����ױ���ȡ��CCl4�С�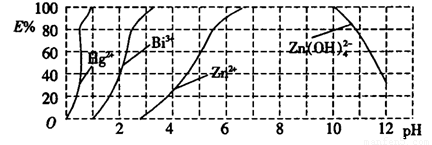
 Cu(HDz)2+2H����
Cu(HDz)2+2H����