题目内容
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,再加入CCl4
、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4
、Cu (HDZ)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:_____________________。萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是___________________________。
(2)如图是用双硫腙(HzDz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~ CCl4络合萃取法处理废水。
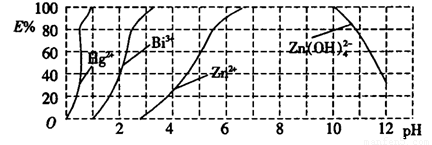
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=________。
②当调节pH=2时,铋(Bi)的存在形式有_________________。
(3)污水中的亚汞离子(Hg2+ 2)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化(Hg2+ 2),写出该反应的化学方程式:________________________。
(1)Fe3++3H2DZ Fe(HDZ)3+3H+
(2分) ;Fe3+会形成Fe(OH)3沉淀(1分)
Fe(HDZ)3+3H+
(2分) ;Fe3+会形成Fe(OH)3沉淀(1分)
(2)①1(1分)②Bi3+、Bi(HDZ)3(2分)
(3)Hg2Cl2+K2S2O3 = 2HgSO 4↓+2 KCl(2分)
【解析】
试题分析:
(1)络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,可得Fe3++3H2DZ
Cu (HDZ)2+2H+,可得Fe3++3H2DZ Fe(HDZ)3+3H+;如果溶液的pH过大,其后果是Fe3+会形成Fe(OH)3沉淀,得不到Fe(HDZ)3;
Fe(HDZ)3+3H+;如果溶液的pH过大,其后果是Fe3+会形成Fe(OH)3沉淀,得不到Fe(HDZ)3;
(2)①观察图片,分析可得须控制溶液的pH=1;调节pH=2时,铋(Bi)部分生成Bi(HDZ)3,存在形式有Bi3+、Bi(HDZ)3。
(3)根据化合价变化可得Hg2Cl2+K2S2O3 = 2HgSO 4↓+2 KCl。
考点:本题以化学工艺流程为基础,考查了元素及化合物性质、氧化还原反应计算,结合图像的化学计算。




 Cu(HDz)2+2H+,
Cu(HDz)2+2H+,