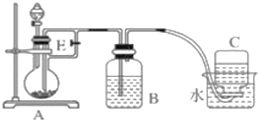
��Ŀ����
����Ŀ��Ϊ�ⶨ̼��Ʒ�ĩ�Ĵ���(������SiO2)��ijѧУѧ����������¼���ʵ�鷽����
����һ���ٳ�ȡ̼�����ƷM g���ڼ������������ռ����ⶨ���ɵ��������V mL��
���������ٳ�ȡ̼�����ƷM g������c mol/L����V mL(����)�ܽ���Ʒ����ȡ�ܽ�����Һ��c��mol/L NaOH��Һ�ζ���ǡ��ȥV�� mL��
���������ٳ�ȡ̼�����ƷM g���ڸ���1000 ������ֱ���������ٸı䣬��ȴ�����������ΪM�� g��
�����ģ��ٳ�ȡ̼�����ƷM g���ڼ�������c mol/L����V mLʹ֮��ȫ�ܽ⣻�۹��˲�ȡ��Һ��������Һ�м��������c��mol/L Na2CO3��ҺV��mL���ݽ�������еij����˳���ϴ�ӡ��������ΪM��g��
��������ʵ�鷽���ش��������⣺
��1������һ�����������Ʒʱ������ײ���һ��δ�����ֵIJ�ȱ����ô��õ�̼��ƴ��Ȼ�(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
��2���������У��г���ʵ�������õ�����������(������̨���ձ�������̨������)��
��3���������еġ���ȴ��Ӧ��β�������
��������
��4���������м���̼��ƴ��ȵĹ�ʽΪ���������Ҫ����������ϴ�ӣ����δ��ϴ�ӣ���ⶨ���̼��ƴ��Ƚ�(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
��5���������������ʵ�����������ס���������ʵ�����Ĵ�С�ȷ�������ۺ��жϣ�����Ϊ�ĸ������У���õķ�����������������ȱ��ֱ��ǣ�
�����ģ�������ϴ�ӡ���������������̸��ӣ�������ɽϴ���
��������
��������
���𰸡�
��1��ƫ��
��2��
������ƽ��ҩ�ס��ζ��ܼС���ʽ�ζ��ܡ���ʽ�ζ��ܡ���ƿ��������
��3���ڸ���������ȴ����ֹ���ɵ�������������е�ˮ������Ӧ����������ı���������
��4��![]() ��100%��ƫ��
��100%��ƫ��
��5����������һ������������Բ���ȷ��������������Ӱ��̫������ʵ���¶ȸ�(1000 ��ĸ���)����ʵ������Ҫ��ϸ�
��������(1)����ײ��в�ȱ����������Ʒ������ƫС��ͨ��ʵ������õĶ�����̼�����ƫС���������̼�����Ʒ����ƫ�ͣ�(2)��ȡ̼�����Ʒ��Ҫ������ƽ��ҩ�ף���ȡ��������ʽ�ζ��ܣ��������ܽ���Ʒʱ��Ҫ�ձ��Ͳ�������������������Һ�ζ���Ҫ����̨���ζ��ܼС���ʽ�ζ��ܡ���ƿ��������(3)̼��Ʒֽ��������������ƣ��������ƻ����տ����е�ˮ�������ʱ����ڸ���������ȴ��(4)̼�����Ʒ�����ᷴӦ�������Ե����ʹ��˳�ȥ������Һ�м��������̼������Һ���γ�̼��Ƴ��������δϴ�ӣ���������ϲ����Ȼ��ƣ�������̼��ƵĴ���ƫ�ߣ����㹫ʽΪ ![]() ��100%��(5)��ʵ�����������Ͳ��������ʵ������С�ۺ��жϣ��ĸ���������õ��Ƿ�����������һ��ȱ���������������Բ��������������������¶Ⱥ�ѹǿ��Ӱ�죻��������ȱ���Ǽ���������¶�̫�ߡ�
��100%��(5)��ʵ�����������Ͳ��������ʵ������С�ۺ��жϣ��ĸ���������õ��Ƿ�����������һ��ȱ���������������Բ��������������������¶Ⱥ�ѹǿ��Ӱ�죻��������ȱ���Ǽ���������¶�̫�ߡ�