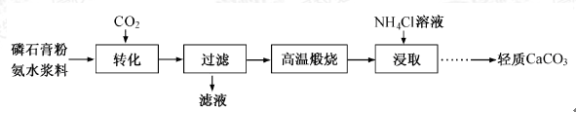
题目内容
【题目】已知氧化性:Cl2>Fe3+>I2>S,在强酸性溶液中,下列各组离子能大量共存的是( )
A.Na+、K+、I﹣、Cl﹣B.Na+、I﹣、SO42﹣、Fe3+
C.Ba2+、K+、HCO3﹣、NO3﹣D.Ba2+、Na+、SO42﹣、Cl﹣
【答案】A
【解析】
A. Na+、K+、I、Cl之间不反应,且都不与氢离子反应,在强酸性溶液中能够大量共存,故A正确;
B. I、Fe3+之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C. HCO3与氢离子反应,在强酸性溶液中不能大量共存,故C错误;
D. Ba2+、SO42之间生成硫酸钡沉淀,在溶液中不能大量共存,故D错误;
故选A。

练习册系列答案
相关题目