题目内容
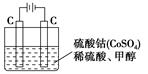
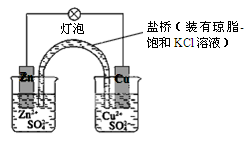
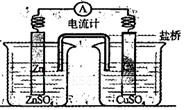
关于如图所示装置的叙述正确的是

| A.铜是阳极,铜片上有气泡产生 |
| B.铜离子在铜片表面被氧化 |
| C.电子从锌片经外电路流向铜片 |
| D.正极附近的SO42-离子浓度逐渐增大 |
C
试题分析:本题考查原电池原理。含有盐桥的铜锌原电池中,较活泼的金属锌作负极,失电子发生氧化反应,电极反应为Zn - 2e- = Zn2+;较不活泼的金属铜作正极,正极上得电子发生还原反应,电极反应式Cu2+ + 2e-=Cu;电子从负极沿导线流向正极。A、铜是正极,电极反应式为Cu2+ + 2e-=Cu,铜片上有金属铜析出,错误;B、铜离子在铜片表面得电子,被还原,错误;C、电子从锌片经外电路流向铜片,正确;D、盐桥中的阴离子向硫酸锌溶液中迁移,阳离子向硫酸铜溶液中迁移,正极附近的SO42-离子浓度基本不变,错误。

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
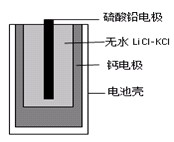
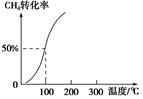
 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。