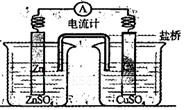
题目内容
有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C;
③A、C用导线相连后,同时浸入稀H2SO4中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此判断四种金属的活动性顺序为( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
①A、B用导线相连后,同时浸入稀H2SO4中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C;
③A、C用导线相连后,同时浸入稀H2SO4中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此判断四种金属的活动性顺序为( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
B
金属与稀H2SO4组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在其表面得到电子生成H2,外电路中电子流动方向由负极―→正极,电流方向则由正极―→负极。在题述原电池中,A—B—稀H2SO4原电池,A为负极;C—D—稀H2SO4原电池,C为负极;A—C—稀H2SO4原电池,A为负极;B—D—稀H2SO4原电池,D为负极。综上可知,金属活动性为:A>C>D>B。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目

 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )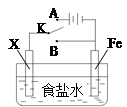
 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑