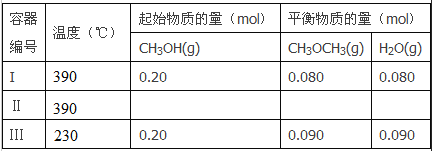
��Ŀ����
����Ŀ����������п�������Ļ��Լ�����ǿ����������п��Ʒ�������������CuO��SiO2�����ʣ�Ϊԭ���Ʊ���������п��������������Ʒ��������������������
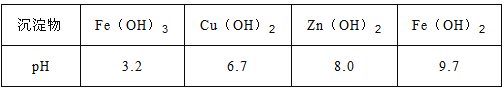
��֪��Zn(OH)2������NaOH��Һ��һЩ������������������ʽ��ȫ����ʱ��Һ��pH���±���
��1������A���õIJ����������ձ���©����______________��
��2�����ܽ⡱ǰ������п��Ʒ�����ϸ������Ŀ����____________________��
��3������������ɻ��յĽ�����_______________��
��4��������������ҺN�м���������H2O2��Һ���ټ�һ����ij�Լ�������ҺpH=5����Fe3+Ũ��Ϊ__________����֪Ksp[Fe(OH)3]=4.0��10-34��
��5����K3[Fe(CN)6]�����軯�أ���֤N��Fe2+��������___________��
��6�����������ijɷ�ΪZnCO3��2Zn(OH)2��H2O�������ա���450��500���½��У����ջ��ZnO�ķ�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��7��ȡ20.00mL�˶�N����0.02mol/L��KMnO4��Һ���еζ�������KMnO4��Һ18.00mL������ҺN��Fe2+��Ũ��Ϊ__________________��
���𰸡���1������������2�������Һ�Ӵ�������ӿ��ܽ�ʱ�ķ�Ӧ���ʣ���3��Cu��
��4��c(Fe3+)=4.0��10-7mol/L����5������ɫ�������ɣ�
��6��ZnCO3��2Zn(OH)2��H2O![]() 3ZnO��3H2O��CO2������7��0.09mol/L
3ZnO��3H2O��CO2������7��0.09mol/L
��������
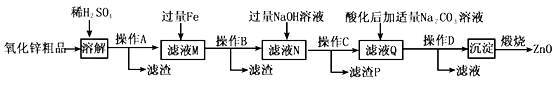
������������������Ϣ�ͻ�ѧ��������֪������п��Ʒ�������������CuO��SiO2�����ʣ���ϡ�������ܽ���������ͭ������п��������������������������A���ˣ������ijɷ�Ϊ�������裻����ҺM�м����������������������Ӧ����������������������ͭ��Ӧ��������������ͭ�����˵���������ͭ�Ļ�����ҺNΪ��������������п�Ļ�������ҺN�мӹ�������������Һ����Ԫ��ת��Ϊ����������������ˣ�����P����Fe(OH)2��Fe(OH)3����ҺQ�ữ�����̼������Һ��пԪ��ת��Ϊ���������յ�����п��
��1������A�ǹ��ˣ����õIJ����������ձ���©������������
��2�����ܽ⡱ǰ������п��Ʒ�����ϸ��������Ŀ��������Ӵ����ʹ���ܳ�ַ�Ӧ��
��3���������Ϸ�����֪����������ɻ��յĽ���ͭ��
��4��pH=5ʱ��Һ��������Ũ����10��9mol/L��������Һ��������Ũ�ȣ�![]() ��4.0��10-7mol/L��
��4.0��10-7mol/L��
��5����K3[Fe(CN)6]�����軯�أ���֤N��Fe2+������������ɫ�������ɣ�
��6�����������ijɷ�ΪZnCO3��2Zn(OH)2��H2O���������յķ���ʽΪZnCO3��2Zn(OH)2��H2O![]() 3ZnO��3H2O��CO2����
3ZnO��3H2O��CO2����
��7�����ݵ���غ��֪��ҺN��Fe2+��Ũ����![]() ��0.09mol/L��
��0.09mol/L��