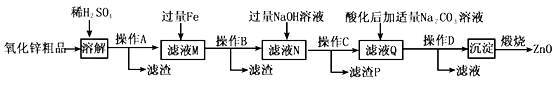
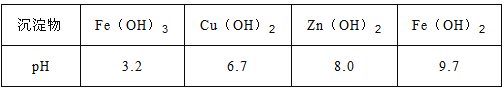
题目内容
【题目】在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO![]() +16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的( )
+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的( )
A.Na2O2既是氧化剂,又是还原剂
B.O2是还原产物,Mn2+是氧化产物
C.通常用浓盐酸酸化高锰酸钾溶液
D.标准状况下,产生22.4 L O2时反应转移2 mol e﹣
【答案】D
【解析】
试题分析:在2MnO4﹣+12H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+中,2MnO4﹣→2Mn2+,Mn元素的化合价由+7价→+2价,得到2×5e﹣,Mn元素的化合价降低其所在的物质高锰酸钾是氧化剂,5Na2O2→5O2,O元素的化合价由﹣1价→0价,失去10×e﹣,过氧化钠是还原剂,以此来解答.
解:A.过氧化钠中O元素的化合价升高,则过氧化钠是还原剂,故A错误;
B.Mn元素的化合价降低,被还原,O元素的化合价升高被氧化,则O2是氧化产物,Mn2+是还原产物,故B错误;
C.用浓盐酸酸化高锰酸钾溶液发生氧化还原反应,应利用稀硫酸酸化,故C错误;
D.标准状况下,产生22.4L O2时反应转移![]() ×2×[0﹣(﹣1)]=2mol e﹣,故D正确;
×2×[0﹣(﹣1)]=2mol e﹣,故D正确;
故选D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目