��Ŀ����
����Ŀ��һ���¶��£������������Ϊ2L�ĺ����ܱ������з�����Ӧ��
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)

�ش��������⣺
��1����Ӧ����H_________O �����������������������жϵ�������_____________������I����ƽ�������ʱ��Ϊ20s����Ӧ����v(CH3OH)Ϊ_________mol/(L��s)��390��ʱ�÷�Ӧ��ƽ�ⳣ��K1=________������ֵ����
��2������II��ƽ��ʱ��ѹǿ������I��������CH3OH���������������I�е���ͬ��CH3OH��ʼ�����ʵ���Ϊ__________��ƽ��ʱCH3OH(g)���������Ϊ___________��
��3��t���Ӻ�����III�ﵽƽ�⣬t_________20s������>����<������=�������жϵ�������________��
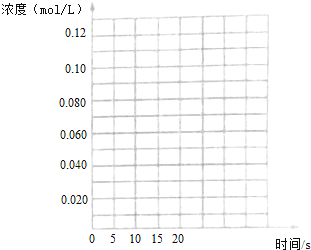
������ͼ�зֱ�����I������III��CH3OH(g)Ũ�ȱ仯������ʾ��ͼ��
��4��390��������3L�����г���0.9mol CH3OH(g), 0.6mol CH3OCH3(g)��0.3molH2O(g)������ʼʱ�÷�Ӧ����V��_________V�档������>����<������=����
���𰸡���1��<��1�֣���Ͷ������ͬʱ���¶ȸߵ�������ƽ��ʱ�����ѵ����ʵ���С��˵����ӦΪ���ȷ�Ӧ����HС��0����2�֣�0.004��2�֣���K1=4��1�֣�����2��0.40mol��1�֣���0.4��1�֣���
��3��>(1��)���״�����ʼŨ����ͬ��������I���¶ȴ�������III���¶ȣ��¶�Խ�ߣ��ٶ�Խ�죻

��4��>��2�֣�
��������
�����������1����ѧƽ�ⳣ���Ĵ�Сֻ���¶��йأ������¶ȣ�ƽ�������ȵķ����ƶ�����Ӧ��������ʼ����ͬ������CH3OCH3��g�������ͣ�˵�����������ƶ�������ӦΪ���ȹ��̣�������HС��0��
2CH3OH��g��![]() CH3OCH3��g��+H2O��g��
CH3OCH3��g��+H2O��g��
��ʼ����mol�� 0.2 0 0
ת������mol�� 0.16 0.08 0.08
ƽ������mol�� 0.04 0.08 0.08
����v��CH3OH��=![]() =0.004molL-1min-1
=0.004molL-1min-1
ƽ�ⳣ��K=c(CH 3OCH 3)c(H 2O)/c 2(CH 3OH) =0.08��0.08/0.042=4
��2����������ƽ��ʱ��CH3OH������������������е���ͬ����Ϊ��Чƽ�⣬�ָ÷�ӦΪ�����������ķ�Ӧ������ֻҪ��Ӧ��ɱ�������Ч����ѹǿ��������ƽ��ʱ�������������������Կ�ʼ��Ӧ��ҲӦ��������������������CH3OH��ʼ�����ʵ���Ϊ0.40mol����Чƽ������ʵ����������ͬ������ƽ��ʱCH3OCH3��g���������������������ͬ�����ݣ�1��������ʽ����������ƽ��ʱCH3OCH3��g�����������Ϊ![]() =0.4������������ƽ��ʱCH3OCH3��g�����������ҲΪ0.4��
=0.4������������ƽ��ʱCH3OCH3��g�����������ҲΪ0.4��
��3���¶�Խ�ͣ���Ӧ����ԽС���ﵽƽ��ʱ�����ʱ��Խ������������ȣ������¶ȵͣ���Ӧ����ԽС����Ҫ��ʱ�䳤������t���Ӻ��������ﵽƽ�⣬t����20min�������������������������ݣ���ʼʱCH3OH��g��Ũ����ͬ��ƽ��ʱ������CH3OH��g��Ũ��Ϊ(0.200.08��2)/2=0.02mol/L��ƽ��ʱ������CH3OH��g��Ũ��Ϊ(0.200.09��2)/2=0.01mol/L������ͼ��Ϊ�����𰸣���
��4��c��CH3OH��=0.9��3=0.3mol/L��c��CH3OCH3 ��=0.6��3=0.2mol/L��c��H2O��=0.3��3=0.1mol/L��Ũ����=��0.2��0.1��/0.32=2/9����Ϊ390��ʱ�÷�Ӧ��ƽ�ⳣ��K=4������ƽ��������Ӧ�����ƶ���v����v����

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�