题目内容
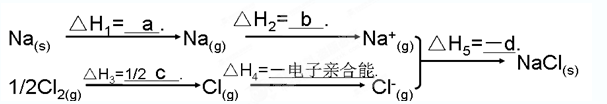
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+1/3CO(g)="=" 2/3Fe3O4(s)+ 1/3C02(g) △H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______________________
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+1/3CO(g)="=" 2/3Fe3O4(s)+ 1/3C02(g) △H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______________________
CO(g)+FeO(s)= Fe(s) + CO2(g) △H=-218.00 kJ/mol(3分)
(无聚集状态和不配平都不得分)
(无聚集状态和不配平都不得分)
根据盖斯定律可知,(①-①-③×2/3)÷2即得到CO(g)+FeO(s)= Fe(s) + CO2(g),所以反应热是△H=(-24.8kJ/mol+15.73kJ/mol+640.4kJ/mol×2/3)÷2=-218.00 kJ/mol。

练习册系列答案
相关题目
 2NH3(g), △H="-92.4" kJ·mol—1,则H—H键的键能是( )
2NH3(g), △H="-92.4" kJ·mol—1,则H—H键的键能是( )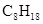 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )

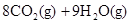
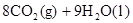
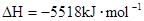

 B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。