题目内容
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
D
解析

一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=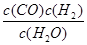 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为______________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
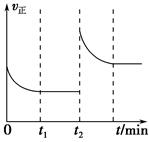
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)=SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如下图所示。下列结论中错误的是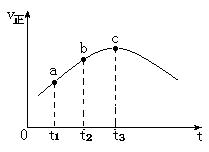
| A.反应在c点达到平衡状态 |
| B.反应物的浓度:a点大于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.逆反应速率:c点大于b点 |
铝的以下反应得以进行的原因,可用勒沙特勒原理解释的是
| A.与盐酸反应产生氢气 |
| B.在氯气中燃烧 |
| C.放入硝酸汞溶液中表面形成铝汞齐 |
| D.一定温度下,用铝与氧化钙反应制得金属钙 |
汽车尾气净化中的一个反应如下: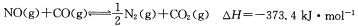
在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
| A.达到平衡后,若只升高温度,化学平衡正向移动 |
| B.达到平衡后,再通人稀有气体,逆反应速率增大 |
| C.使用催化剂,平衡常数不变 |
| D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1 |
向一容积为1 L的密闭容器中加入一定量的X、Y,发生反应aX(g)+2Y(s) bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息,下列说法正确的是 ( )。
| A.用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1 |
| B.根据上图可求得化学方程式中a∶b=1∶3 |
| C.推测在第7 min时曲线变化的原因可能是升温 |
| D.推测在第13 min时曲线变化的原因可能是降温 |
在5 mL 0.1 mol·L-1 KI溶液中滴加0.1 mol·L-1 FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3与KI的反应是可逆反应的实验(含现象)是( )
| A.滴加AgNO3溶液,有黄色沉淀产生 |
| B.加入CCl4振荡,下层液体为浅紫色 |
| C.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加AgNO3溶液,有白色沉淀产生 |
| D.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加KSCN溶液,溶液显红色 |
工业上常用还原沉淀法处理含铬废水(Cr2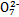 和Cr
和Cr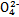 ),其流程为:Cr
),其流程为:Cr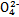
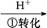 Cr2
Cr2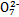
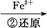 Cr3+
Cr3+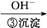 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr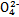 (黄色)+2H+
(黄色)+2H+ Cr2
Cr2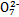 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr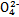 浓度增大 浓度增大 |
B.步骤①中当2v(Cr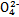 )=v(Cr2 )=v(Cr2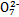 )时,说明反应2Cr )时,说明反应2Cr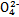 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2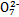 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2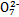 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |