题目内容
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流程为:Cr
),其流程为:Cr
 Cr2
Cr2
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大 浓度增大 |
B.步骤①中当2v(Cr )=v(Cr2 )=v(Cr2 )时,说明反应2Cr )时,说明反应2Cr (黄色)+2H+ (黄色)+2H+ Cr2 Cr2 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |
D
解析

某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  ?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
下列说法中正确的是
| A.30~40 min该反应使用了催化剂 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.30 min时降低压强,40 min时升高温度 |
| D.8 min时反应第一次达到平衡 |
下列表格中的各种情况,可以用下面的图象曲线表示的是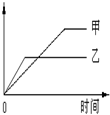
| | 反应 | 纵坐标 | 甲 | 乙 |
| A | 等质量钾、钠分别与足量水反应 | H 2质量 | 钠 | 钾 |
| B | 相同质量氨气,在同一容器中 2NH3 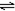 N2+3H2 ΔH >0 N2+3H2 ΔH >0 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2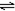 2NH3 2NH3 | 氨气的浓度 | 活性一般的催化剂 | 活性高的催化剂 |
| D | 2molSO2与lmolO2,在相同温度下2SO2(g)+O2(g)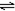 2SO3(g) 2SO3(g) | SO3物质的量 | 2个大气压 | 10个大气压 |
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是 1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0。
CO2(g)+H2(g) △H<0。
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K= 。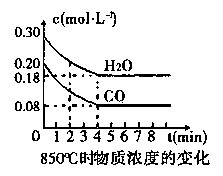
0~4 min的平均反应速率v(CO)= mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
①表中3 min~4 min之间反应处于 状态;cl数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,C(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0
MgO(s)+CO2(g)+SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后;纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
下列反应中符合下图图像的是 ( )。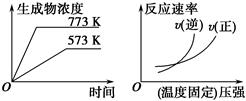
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) |
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |