��Ŀ����
����Ŀ����ˮռ�����ܴ�ˮ����97.2%�����Ѻ�ˮ�����ͻ�����������������ȿ��Խ����ˮ��Դȱ�������⣬�ֿ��Գ�����ú�����Դ��
��1����ˮ�к��д������Ȼ��ơ��Ȼ����еĽ���Ԫ��λ��Ԫ�����ڱ���________�塣
��2��Ŀǰ������ʹ�õġ���ˮ��������Ҫ����֮һ�����������ǽ���ˮ�������������������ȴ���øߴ��ȵ�ˮ���ɴ˿��ж�������________(������仯����ѧ�仯��)��
��3����ҵ�����õ�ⱥ��ʳ��ˮ���Ƶ���Ҫ������Ʒ����Ӧ����ʽΪ��2NaCl��2H2O2NaOH��H2����Cl2�������õ������������36.5%��Ũ����1000 t��������Ҫ����ʳ��________t��
��4�����������������һ�������ȼҵ��Ʒ���Ȼ���ѭ������������������������ն�������ķ������÷������������£�
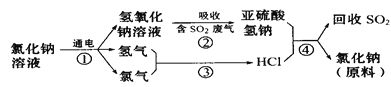
д���ڢܵĻ�ѧ��Ӧ����ʽ______________________________�� _________________��
��5�������������������ȩ����һ����Ӧ�����Ժϳ��׳ơ����顱�����ʡ������������к�����������ʳƷƯ�ס���ṹ��ʽΪHOCH2SO3Na��������ṹ�ص㣬�����顱�ܷ����ķ�Ӧ��________��
A��������Ӧ B���ۺϷ�Ӧ C��������Ʒ�Ӧ D��������Ӧ
���𰸡� ��A �����仯 585 NaOH��SO2===NaHSO3 NaHSO3��HCl===NaCl��H2O��SO2�� C��D
����������1���Ƶ�ԭ��������11��λ�����ڱ��ĵ�IA�������������2�����������ݻ�����и���ַе㲻ͬ�������һ�ַ����������ڳ�ȥ�ӷ����ѻӷ��ӷ����ʣ����������������仯��(3)���ݷ�Ӧ�Ļ�ѧ����ʽ2NaCl��2H2O![]() 2NaOH��H2����Cl2����H2��Cl2
2NaOH��H2����Cl2����H2��Cl2![]() 2HCl��֪����n(HCl)��
2HCl��֪����n(HCl)��![]() ��10��106 mol����m(NaCl)��10��106mol��58.5 g/mol��585��106 g��585 t����4��SO2�������������ܺ��������Ʒ�Ӧ�������������ƣ��������������ܺ��ᷴӦ��������SO2����Ӧ�Ļ�ѧ����ʽ��NaOH��SO2=NaHSO3��NaHSO3��HCl===NaCl��H2O��SO2����(5)�������������ȩ�ķ�Ӧʵ�����Ǽӳɷ�Ӧ��HCHO��NaHSO3�D��HOCH2SO3Na���ɽṹ��ʽ�ɿ����д��ǻ������ܷ���������Ƶķ�Ӧ��������Ӧ������Ǵ��ĵ��ͷ�Ӧ����ѡCD��
��10��106 mol����m(NaCl)��10��106mol��58.5 g/mol��585��106 g��585 t����4��SO2�������������ܺ��������Ʒ�Ӧ�������������ƣ��������������ܺ��ᷴӦ��������SO2����Ӧ�Ļ�ѧ����ʽ��NaOH��SO2=NaHSO3��NaHSO3��HCl===NaCl��H2O��SO2����(5)�������������ȩ�ķ�Ӧʵ�����Ǽӳɷ�Ӧ��HCHO��NaHSO3�D��HOCH2SO3Na���ɽṹ��ʽ�ɿ����д��ǻ������ܷ���������Ƶķ�Ӧ��������Ӧ������Ǵ��ĵ��ͷ�Ӧ����ѡCD��

 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
����Ŀ��
��1����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.4kJ/mol
2NH3(g) ��H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol
д����������������һ�����������ˮ�������Ȼ�ѧ��Ӧ����ʽ��
��2��ij����С���о����������������������£��ı���ʼ�����������ʵ�����N2(g)+3H2(g) ![]() 2NH3(g)��Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
2NH3(g)��Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����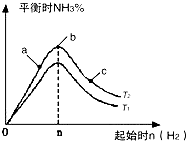
��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2T1������ڡ��������ڡ��������ڡ�������ȷ��������
�����Ƚ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���������ĸ����
��3��N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��һ���¶��£��ں����ܱ�������N2O5�ɷ������з�Ӧ��2N2O5(g) ![]() 4NO2(g) + O2(g).��H��0���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
4NO2(g) + O2(g).��H��0���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
| 0 | 500 | 1000 |
| 5.00 | 3.52 | 2.48 |
��500s��NO2��ƽ����������Ϊ��
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��

