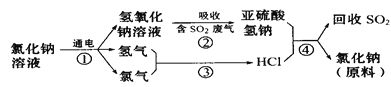
��Ŀ����
����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
���𰸡���ԭ��1.5mol��Cu2��OH��2CO3��Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������CuO+2e��+2Li+=Li2O+Cu��2Cu��2e��+2OH��=Cu2O+H2O��Cu2O+2H+=Cu2++Cu+H2O��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ��
����������1��������Ӧ��CuԪ�ػ��ϼ���+2�ۻ�+2��ת��Ϊ0�ۣ�������ԭ��Ӧ������CuԪ�ر���ԭ�����âٷ�ÿ�Ƶ�32gCu��n��Cu��=![]() =0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
=0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
���Դ��ǣ���ԭ�� 1.5mol��
��2��Cu��������������̼��ˮ��Ӧ����Cu2��OH��2CO3 �� ����ͭ�̵Ļ�ѧʽΪCu2��OH��2CO3 �� �����������õ��Ӻ�ˮ��Ӧ�������������ӣ��缫��ӦʽΪO2+2H2O+4e��=4OH����Zn��Cu�͵���ʹ���ԭ��أ�Zn��ʧ���Ӷ���������Cu���������������������÷���Ϊ�������������������Դ��ǣ�
Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������
��3����������CuO�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCuO+2e��+2Li+=Li2O+Cu�����Դ��ǣ�CuO+2e��+2Li+=Li2O+Cu��
��������ͭʧ���Ӻ����������ӷ�Ӧ����������ͭ��ˮ���缫��ӦʽΪ2Cu��2e��+2OH��=Cu2O+H2O��������ͭ��ϡ���ᷴӦ��������ͭ��Cu��ˮ�����ӷ���ʽΪCu2O+2H+=Cu2++Cu+H2O�����Դ��ǣ�2Cu��2e��+2OH��=Cu2O+H2O�� Cu2O+2H+=Cu2++Cu+H2O��
��4��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У����Դ��ǣ�Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У�

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�����Ŀ����ú�ң���Ҫ����SiO2��Fe2O3��Al2O3�ȣ���ȼú��������в����ķ�������ú�ҵ��ۺ����þ��кܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ������룮
��д��������Һ��Fe2O3��Ӧ�����ӷ���ʽ ��
�ڳ�������õ���������Ҫ�ɷ��� ��
��2����1���������õ���Һ�м��뻹ԭ��ʹFe3+ת��ΪFe2+ �� ��ϱ�������ԭ�� ��
���� | Fe��OH��2 | Fe��OH��3 | Al��OH��3 |
�������䣨pH�� | 7.06��8.95 | 1.94��3.20 | 3.69��4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�飮
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ ��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ����ͼ1������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�ķ�Χ�� �� ѡ��÷�Χ�������� �� 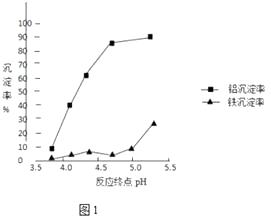
��4����NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ�������[NH4Al��SO4��2]��Ȼ����롢���ջ�ô�Al2O3 ��
��֪������泥����ܽ�ȣ�0��ʱ��S=5.2g��100��ʱ��S=421.9g��
��280��ʱ�ֽ⣮
�������Ͽ�֪��������������������ʷ���ķ����� ��
��5������NH4Al��SO4��2ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������16mol������尴ͼ2װ�ñ���ȫ�����Ƶý�ȡҺ���뽫ͼ2���Լ��������ʵ�������������