题目内容
X、Y、Z、W是周期表前四周期中的常见元素,它们的原子序数依次增大,其相关信息如下表:
请根据以上信息回答下列问题:
(1)X元素所在族中的两种短周期元素形成的原子晶体的化学式为 ;其熔点比X、Y两元素形成的化合物的熔点 (填“高”或“低”).
(2)Z元素与Y元素所形成的原子个数比为1:1的化合物的电子式为 .
(3)W元素基态原子的价电子排布式为 ;W或W的化合物,是中学化学课本中常见反应的催化剂,请写出其中一个用W或W的化合物做催化剂的化学反应的化学方程式: .
(4)已知:X(s)+Y2(g)=XY2(g)△H1=-393.5KJ?mol-1
XY(g)+
Y2(g)=XY2(g)△2=-282.9kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为: .
| 元素 | 相关信息 |
| X | X元素是所在族中原子半径最小的元素,X元素及同族元素能形成多种属于原子晶体的单质和化合物. |
| Y | Y元素有两种氢化物,且其基态原子中s轨道电子总数和p轨道电子总数相等. |
| Z | Z+的离子半径小于Y2-的离子半径 |
| W | W元素的最外电子层上只有一个电子,工业上用电解精炼法获得其纯金属. |
(1)X元素所在族中的两种短周期元素形成的原子晶体的化学式为
(2)Z元素与Y元素所形成的原子个数比为1:1的化合物的电子式为
(3)W元素基态原子的价电子排布式为
(4)已知:X(s)+Y2(g)=XY2(g)△H1=-393.5KJ?mol-1
XY(g)+
| 1 |
| 2 |
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为:
分析:X、Y、Z、W是周期表前四周期中的常见元素,它们的原子序数依次增大.X元素是所在族中原子半径最小的元素,X元素及同族元素能形成多种属于原子晶体的单质和化合物,则X为C元素;Y元素有两种氢化物,且其基态原子中s轨道电子总数和p轨道电子总数相等,则核外电子排布为1s22s22p4,Y为O元素;Z+的离子半径小于Y2-的离子半径,Z形成+1价离子,处于ⅠA族,结合原子序数可知Z为Na;W元素的最外电子层上只有一个电子,工业上用电解精炼法获得其纯金属,则W为Cu,据此解答.
解答:解:X、Y、Z、W是周期表前四周期中的常见元素,它们的原子序数依次增大.X元素是所在族中原子半径最小的元素,X元素及同族元素能形成多种属于原子晶体的单质和化合物,则X为C元素;Y元素有两种氢化物,且其基态原子中s轨道电子总数和p轨道电子总数相等,则核外电子排布为1s22s22p4,Y为O元素;Z+的离子半径小于Y2-的离子半径,Z形成+1价离子,处于ⅠA族,结合原子序数可知Z为Na;W元素的最外电子层上只有一个电子,工业上用电解精炼法获得其纯金属,则W为Cu,
(1)C元素所在族中的两种短周期元素形成的原子晶体的化学式为SiC;C、O两元素形成的化合物为CO或CO2,为分子晶体,故SiC的熔点高,故答案为:SiC;高;
(2)Na元素与O元素所形成的原子个数比为1:1的化合物为Na2O2,其电子式为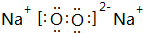 ,故答案为:
,故答案为: ;
;
(3)W为Cu元素,核外电子数为29,基态原子的价电子排布式为3d104s1;用Cu或Cu的化合物是中学化学中常见反应的催化剂,用Cu或Cu的化合物做催化剂的化学反应的化学方程为:2CH3CH2OH+O2
2CH3CHO+2H2O等,
故答案为:3d104s1;2CH3CH2OH+O2
2CH3CHO+2H2O等;
(4)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5KJ?mol-1
②CO(g)+
O2(g)=CO2(g)△2=-282.9kJ?mol-1
根据盖斯定律,①-②得C(s)+
O2(g)=CO(g)△H=-110.6KJ?mol-1,
故答案为:C(s)+
O2(g)=CO(g)△H=-110.6KJ?mol-1.
(1)C元素所在族中的两种短周期元素形成的原子晶体的化学式为SiC;C、O两元素形成的化合物为CO或CO2,为分子晶体,故SiC的熔点高,故答案为:SiC;高;
(2)Na元素与O元素所形成的原子个数比为1:1的化合物为Na2O2,其电子式为
 ,故答案为:
,故答案为: ;
;(3)W为Cu元素,核外电子数为29,基态原子的价电子排布式为3d104s1;用Cu或Cu的化合物是中学化学中常见反应的催化剂,用Cu或Cu的化合物做催化剂的化学反应的化学方程为:2CH3CH2OH+O2
| Cu |
| △ |
故答案为:3d104s1;2CH3CH2OH+O2
| Cu |
| △ |
(4)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5KJ?mol-1
②CO(g)+
| 1 |
| 2 |
根据盖斯定律,①-②得C(s)+
| 1 |
| 2 |
故答案为:C(s)+
| 1 |
| 2 |
点评:本题考查结构性质位置关系应用、晶体类型与性质、电子式、核外电子排布、热化学方程式等,推断元素是解题关键,侧重对基础知识的巩固应用,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目