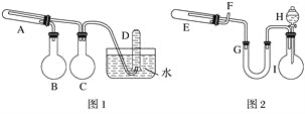
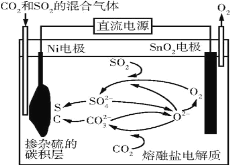
题目内容
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A.x=1
B.2 min内A的反应速率为0.2 mol·L-1·min-1
C.B的转化率为40%
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
【答案】B
【解析】
A、平衡时生成的C的物质的量为0.2mol·L-1×2L=0.4mol,转化物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A正确;
B、2min内生成0.8mol D,故2 min内D的反应速率υ(D)=0.8mol÷2L÷2min=0.2 mol·(L·min)-1,速率之比等于化学计量数之比,故υ(A)=3υ(D)/2=3×0.2 mol·(L·min)-1÷2=0.3 mol·(L·min)-1,故B错误;
C、2min末该反应达到平衡,生成0.8mol D,由方程式3A(g)+B(g)![]() xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol×1/2=0.4mol,故B的转化率为0.4mol÷1mol×100%=40%,故C正确;
xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol×1/2=0.4mol,故B的转化率为0.4mol÷1mol×100%=40%,故C正确;
D、容器的容积不变,混合气体的质量不变,物质的量不断变化,若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态,故D正确;
故选B。

【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。

(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2