题目内容
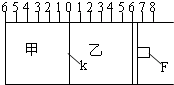 (Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:(1)可根据
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
乙中C的转化率
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(4)甲、乙中C的物质的量是
(5)测得甲中A的转化率为b,则乙中C的转化率为
(6)假设乙、甲两容器中的压强比用d表示,则d的取值范围是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)当物质的量不变时平衡,此时隔板K不再移动;
(2)根据可逆反应的特征分析;
(3)根据(2)中的解析,将a的值换成1,进行计算即可,“隔板K最终停留在左侧1处”说明反应后气体体积为5格,即物质的量为2.5mol,
设参加反应的二氧化硫的物质的量为2x,
故2-2x+1-x+2x=2.5,
则x=0.5mol,
则甲中二氧化硫的转化率为50%,生成三氧化硫物质的量为1mol;
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则 2SO3(g)?2SO2(g)+O2(g)的平衡向右移动了;
(4)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中A转化了2b%,右边乙容器中含有2b%三氧化硫,依据转化率概念计算得到;根据等效平衡和可逆反应的特征判断;
(5)根据压强之比等于气体物质的量之比,依据极值分析判断;
(2)根据可逆反应的特征分析;
(3)根据(2)中的解析,将a的值换成1,进行计算即可,“隔板K最终停留在左侧1处”说明反应后气体体积为5格,即物质的量为2.5mol,
设参加反应的二氧化硫的物质的量为2x,
故2-2x+1-x+2x=2.5,
则x=0.5mol,
则甲中二氧化硫的转化率为50%,生成三氧化硫物质的量为1mol;
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则 2SO3(g)?2SO2(g)+O2(g)的平衡向右移动了;
(4)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中A转化了2b%,右边乙容器中含有2b%三氧化硫,依据转化率概念计算得到;根据等效平衡和可逆反应的特征判断;
(5)根据压强之比等于气体物质的量之比,依据极值分析判断;
解答:
解:(1)根据反应式可知甲中反应达平衡时气体物质的量减小,当物质的量不变时平衡,此时隔板K不再移动,故答案为:隔板K不再移动;
(2)当乙中没有He气时,甲中充入2molA、1molB,与乙中充入2molC到达平衡状态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充入1molHe气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向移动,再次到达平衡时,隔板位于a处,通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5mol气体.隔板在a处时,甲中的气体为0.5×(6-a)mol.
设甲中反应到达平衡时,有xmolB发生反应,
2A(g)+B(g)?2C(g)
开始(mol) 2 1 0
转化(mol) 2x x 2x
平衡(mol) (2-2x) (1-x) 2x
(2-2x)+(1-x)=(6-a)×0.5
0.5a=x
当B完全反应时,x=1,a取最大,即a=2
2molA和1molB完全反应时生成2molC,根据可逆反应不能进行到底可知:K停留在0~2之间某位置,故答案为:0~2;
(3)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明乙端的相当有7个格,即乙中平衡时气体的物质的量为3.5mol,其中He为1mol.
设乙中到达平衡时有ymolC反应
2C(g)?2A(g)+B(g)
开始(mol) 2 0 0
转化(mol) y y
y
平衡(mol) (2-y) y
y
(2-y)+y+
y=2.5
y=1
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则2C(g)?2A(g)+B(g)的平衡向右移动了,故其转化率比大于50%;左边气体减少了0.5mol,右边增加物质的量大于0.5mol,F活塞右移,活塞F最终停留在右侧刻度大于6处;
故答案为:1,>,②;
(4)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中二氧化硫转化了2b%,右边乙容器中含有2b%三氧化硫,乙中三氧化硫的转化率=
=1-b%;
故答案为:=,1-b%;
(5)此题仍要考虑两种极限情况,即A、B完全转化与A、B完全不转化,当A、B完全转化时,恒容,d=
=
=
;当A、B完全不转化时,恒容,d=
=
=
,因此d的取值范围是
<d<
;
故答案为:
<d<
;
(2)当乙中没有He气时,甲中充入2molA、1molB,与乙中充入2molC到达平衡状态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充入1molHe气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向移动,再次到达平衡时,隔板位于a处,通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5mol气体.隔板在a处时,甲中的气体为0.5×(6-a)mol.
设甲中反应到达平衡时,有xmolB发生反应,
2A(g)+B(g)?2C(g)
开始(mol) 2 1 0
转化(mol) 2x x 2x
平衡(mol) (2-2x) (1-x) 2x
(2-2x)+(1-x)=(6-a)×0.5
0.5a=x
当B完全反应时,x=1,a取最大,即a=2
2molA和1molB完全反应时生成2molC,根据可逆反应不能进行到底可知:K停留在0~2之间某位置,故答案为:0~2;
(3)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明乙端的相当有7个格,即乙中平衡时气体的物质的量为3.5mol,其中He为1mol.
设乙中到达平衡时有ymolC反应
2C(g)?2A(g)+B(g)
开始(mol) 2 0 0
转化(mol) y y
| 1 |
| 2 |
平衡(mol) (2-y) y
| 1 |
| 2 |
(2-y)+y+
| 1 |
| 2 |
y=1
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则2C(g)?2A(g)+B(g)的平衡向右移动了,故其转化率比大于50%;左边气体减少了0.5mol,右边增加物质的量大于0.5mol,F活塞右移,活塞F最终停留在右侧刻度大于6处;
故答案为:1,>,②;
(4)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中二氧化硫转化了2b%,右边乙容器中含有2b%三氧化硫,乙中三氧化硫的转化率=
| 2-2b% |
| 2 |
故答案为:=,1-b%;
(5)此题仍要考虑两种极限情况,即A、B完全转化与A、B完全不转化,当A、B完全转化时,恒容,d=
| P乙 |
| P甲 |
| n乙 |
| n甲 |
| 3 |
| 2 |
| P乙 |
| P甲 |
| n乙 |
| n甲 |
| 4 |
| 3 |
| 4 |
| 3 |
| 3 |
| 2 |
故答案为:
| 4 |
| 3 |
| 3 |
| 2 |
点评:本题考查了化学平衡的建立过程分析判断,注意恒温容器和恒压容器中的平衡特征分析,掌握反应过程中的气体变化和平衡建立是解题关键,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为了确定几种物质化学性质活泼性强弱,某同学做了如下实验:有A、B、C、D四种金属,A、B与酸反应放出氢气,C、D不能;A与B接触放在潮湿空气中,B被腐蚀;将C浸入D的盐溶液,C表面有D析出.则四种金属的化学性质由强到弱的顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、B、A、D、C |
| D、C、D、B、A |
下列关于甲烷性质叙述中不正确的是( )
| A、甲烷是一种无色无味的气体 |
| B、甲烷的密度比空气的密度小 |
| C、甲烷极难溶解于水 |
| D、甲烷性质稳定,不和其它物质反应 |
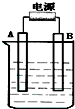 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: