题目内容
8.下面的排序不正确的是( )| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na<Mg<Al | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
分析 A.分子晶体的相对分子质量越大,熔沸点越大;
B.离子晶体键长越短,共价键越强,硬度越大;
C.金属晶体中金属离子的电荷越大、半径越小,其熔点越大;
D.离子半径越小、离子键越强,则晶格能越大.
解答 解:A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,故A正确;
B.键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小为金刚石>碳化硅>晶体硅,故B正确;
C.金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,故C正确;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故D错误;
故选D.
点评 本题考查了晶体熔点的比较、原子晶体的硬度比较,题目难度不大,注意把握构成晶体的微粒以及决定熔点的因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.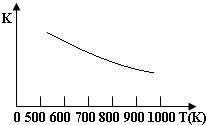 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |
19.有下列离子晶体立体结构示意图:
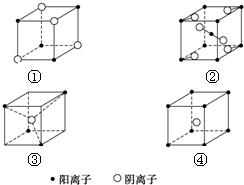
若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )

若以M代表阳离子,以N代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
| A. | ①MN ②MN2 ③MN2 ④MN | B. | ①MN ②MN2 ③MN3 ④MN4 | ||
| C. | ①MN2 ②MN2 ③MN2 ④MN | D. | ①MN ②MN ③MN2 ④MN2 |
13.下列说法正确的是( )
| A. | 化合物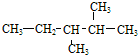 按系统命名法的名称为3,4-二甲基戊烷 按系统命名法的名称为3,4-二甲基戊烷 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 |
20.下列表示对应的离子方程式正确的是( )
| A. | 纯碱与醋酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 等物质的量的SO2和Cl2通入水中:SO2+Cl2+2H2O=4H++SO42-+2Cl- | |
| C. | NH4HCO3溶液与过量的浓NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 锌与稀硝酸反应:Zn+2H+=Zn2++H2↑ |
17.下列物质属于分子晶体的化合物是( )
| A. | 石英 | B. | 硫磺 | C. | 干冰 | D. | 食盐 |
18.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16g CH4所含原子数目为NA | ||
| C. | 17gNH3所含中子数目为10 NA | D. | 20g重水(D2O)所含质子数目为10NA |
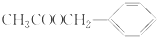 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 .
. ;
;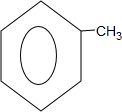 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl.
+HCl. ;
;