题目内容
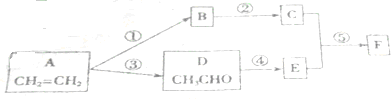
16.《茉莉花》是一首脍炙人口的江苏民歌.茉莉花香气的成分有多种,乙酸苯甲酯(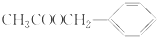 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
(1)C的结构简式为
 .
.(2)写出反应①、④的化学方程式:
①
 ;
;④
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl.
+HCl.(3)反应②(填序号)原子的理论利用率为100%,符合“绿色化学”的要求.
分析 乙醇在Cu或Ag催化作用下加热反应生成CH3CHO(A),CH3CHO继续被氧化为CH3COOH(B), 在碱性条件下水解生成
在碱性条件下水解生成 ,在一定条件下与CH3COOH发生酯化反应生成
,在一定条件下与CH3COOH发生酯化反应生成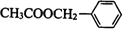 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:醇在Cu或Ag催化作用下加热反应生成CH3CHO(A),CH3CHO继续被氧化为CH3COOH(B), 在碱性条件下水解生成
在碱性条件下水解生成 ,在一定条件下与CH3COOH发生酯化反应生成
,在一定条件下与CH3COOH发生酯化反应生成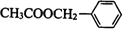 ,则
,则
(1)由以上分析可知C为 ,故答案为:
,故答案为: ;
;
(2)乙醇在Cu或Ag催化作用下加热反应生成CH3CHO,反应①的方程式为 ,甲苯在光照时甲基上发生取代反应,反应④的方程式为:
,甲苯在光照时甲基上发生取代反应,反应④的方程式为: +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,
+HCl,
故答案为: ;
; +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl;
+HCl;
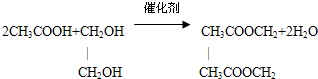
(3)反应①为 ,反应②为2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,反应③为
,反应②为2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,反应③为 ,对比三个反应可知反应②原子的理论利用率为100%,
,对比三个反应可知反应②原子的理论利用率为100%,
故答案为:②.
点评 本题考查有机物的合成,题目难度不大,本题注意结合乙醇、氯代烃的性质进行推断,学习中注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+6b-3a-c-3e)kJ/mol(用相应字母表示),若只加压,则平衡常数K不变(选填“增大”,“减小”或“不变”);
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
下列关系正确的是AD
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)已知2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
H2O(g)=H2O(1)△H=-44.0kJ/mol
甲醇不完全燃烧生成气态水的热化学方程式为2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1
若不完全燃烧20g甲醇生成液态水,此时放出的热量为333.5kJ
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
(3)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1+a2=1
E.该反应若生成1molCH2OH,则放出(Q1+Q3)kJ热量
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH2OH,达到平衡时测得混合气体的密度是同温同压下起始密度的1.6倍,则达平衡前v(正)>v(逆)(填“>”、“<”或“=”);
(5)甲醇一空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间后纯Cu质量增加3.2g(粗铜中杂质不参与电极反应).
①请写出燃料电池中的负极反应式:CH3OH-6e-+8OH-=CO32-+6H2O
②燃料电池正极消耗空气的体积是2.8L(标准状态,空气中O2体积分数以20%计算).
11.验证某有机物是否属于烃的含氧衍生物,应完成的实验内容是( )
| A. | 只验证它完全燃烧后的产物只有H2O和CO2 | |
| B. | 只测定其燃烧产物中H2O和CO2的物质的量的比值 | |
| C. | 测定完全燃烧时消耗的有机物与生成的CO2、H2O的物质的量之比 | |
| D. | 测定该试样的质量及其试样完全燃烧后只生成CO2和H2O并测定CO2和H2O的质量 |
1.下列装置能够组成原电池的是( )
| A. |  | B. | 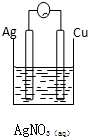 | C. | 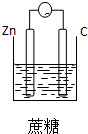 | D. | 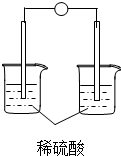 |
8.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na<Mg<Al | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
5.下列说法正确的是( )
| A. | 因为水分子间存在氢键,所有水分子较稳定 | |
| B. | 碘固体升华过程中吸收的热量用于克服碘原子间的作用力 | |
| C. | 溴化氢溶于水能电离出H+、Br-,所以溴化氢是离子化合物 | |
| D. | 纯碱和烧碱的熔化均破坏了离子键 |
6.下列关于著名化学家的名字、国籍及主要贡献的对应关系中,不正确的是( )
| 科学家 | 国籍 | 主要贡献 | |
| A | 贝采利乌斯 | 瑞典 | 首先提出“有机化学”和“有机化合物”的概念 |
| B | 维勒 | 德国 | 首次人工合成了有机物--尿素 |
| C | 李比希 | 法国 | 创立了有机物的定量分析方法 |
| D | 门捷列夫 | 俄国 | 发现元素周期律 |
| A. | A | B. | B | C. | C | D. | D |

 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +nH2O.
+nH2O. .
.

 .
.