题目内容
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1mol Cl2溶于足量水中转移电子数为NA |
| B.在熔融状态下,1molKHSO4完全电离出的阳离子数为2NA |
| C.标准状况下,22.4LNO与CO2的混合气体中含有的原子数为2NA |
| D.CaC2含有的π键的数目为0.2NA |
D
解析试题分析: A、氯气与水是可逆反应,1molCl2溶于足量水中转移电子数小于1mol,错误;B、熔融状态下共价键不断裂,KHSO4熔化状态电离生成K+和HSO4-,错误;C、NO是双原子分子、CO2是三原子分子,错误;D、C22-中两个碳原子之间形成三键,三键中有1个 键、2个
键、2个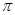 键,正确;
键,正确;
考点: NA

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
| A.1mol过氧化钡(BaO2)晶体中所含有的阴离子数目为2NA |
| B.标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA |
| C.将Imol FeCl3转化为氢氧化铁胶体,得到的氢氧化铁胶体粒子数小于NA |
| D.常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA |
下列叙述正确的是
| A.标准状况下,2.24LNH3中含有6.02×1022个N—H共价键 |
| B.100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C.将4gNaOH溶于100g蒸溜水,所得溶液物质的量浓度是1.0mol/L |
| D.将7.8gNa2O2放入足量的水中,反应时转移6.02×1022个电子 |
设nA是阿伏加德罗常数的数值,下列说法正确的是
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5nA |
| B.4.2 g丙烯中所含的共价键数目为0.6nA |
| C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 nA |
| D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 nA |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.5g | 140.0g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.3CuSO4
 3CuO + SO3↑ + 2SO2↑ + O2↑
3CuO + SO3↑ + 2SO2↑ + O2↑B.4CuSO4
 4CuO + 2SO3↑ + 2SO2↑ + O2↑
4CuO + 2SO3↑ + 2SO2↑ + O2↑C.5CuSO4
 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑D.6CuSO4
 6CuO + 4SO3↑ + 2SO2↑ + O2↑
6CuO + 4SO3↑ + 2SO2↑ + O2↑ 用NA表示阿伏加德罗常数,下列说法中正确的有
| A.lmol Na2O2晶体中共含有4NA个离子 |
| B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C.常温常压下16gO2和O3混合气体含有NA个氧原子 |
| D.1mol?L-1的CaCl2溶液中含Cl-的数目为2NA; |
下列化学用语表示正确的是( )
A.甲基的电子式: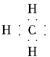 |
B.氮原子的轨道表示式: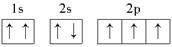 |
| C.氯离子的最外层电子排布:3s23p6 |
D.硫离子的结构示意图: |
一块表面已被氧化为氧化钠的钠块5.4g,投入50g水中,最多能产生0.10g气体,则原来被氧化的钠是( )
| A.2.3g | B.3.1g | C.4.6g | D.5.3g |
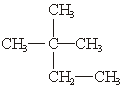 ;③白磷;④氯气;⑤
;③白磷;④氯气;⑤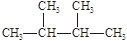 ;⑥
;⑥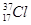 ;⑦
;⑦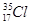 ;⑧红磷
;⑧红磷