题目内容
设nA是阿伏加德罗常数的数值,下列说法正确的是
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5nA |
| B.4.2 g丙烯中所含的共价键数目为0.6nA |
| C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 nA |
| D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 nA |
A
解析试题分析:若只有二氧化氮,其相对分子质量为46,则23g二氧化氮的物质的量为0.5mol,含有0.5mol氮原子,若只有四氧化二氮,其相对分子质量为92,则23g四氧化二氮的物质的量为0.25mol,也含有0.5mol氮原子,若既有二氧化氮又有四氧化二氮,则23g混合气体中含有0.5mol氮原子,故A选项正确;丙烯的分子式为C3H6,相对分子质量为42,则4.2g丙烯的物质的量为0.1mol,1个丙烯中含有6个C—H键、1个C—C键、1个C=C键,则0.1mol丙烯中含有0.6molC—H键、0.1molC—C键、0.1mol C=C键,故B选项错误;由于n=c?V,则硫酸铁的物质的量为0.1mol,由于Fe2(SO4)3=2Fe3++3SO42—中铁离子与硫酸铁的系数之比等于物质的量之比,则0.1mol硫酸铁含有0.2mol铁离子,由于铁离子部分水解,则溶液中铁离子小于0.2mol,故C选项错误;由于n=V/Vm,标准状况下气体摩尔体积为22.4L/mol,则氧气的物质的量为0.05mol,由于2H2O2=2H2O+O2↑~2e—,其中转移电子与氧气的系数之比等于物质的量,则该反应中转移电子的物质的量为0.1mol,故D选项错误。
考点:考查阿伏加德罗常数,涉及质量、摩尔质量、物质的量、物质的组成、物质的结构、溶液体积、物质的量浓度、盐类水解、气体体积、气体摩尔体积、物质的量、氧化还原反应转移电子数、物质的量在化学或电离方程式中的应用、强电解质等。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案下列化学用语表示正确的是 ( )
A.含18个中子的氯原子的核素符号: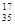 C1 C1 |
B.氟原子结构示意图: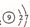 |
| C.1 -丙醇的结构简式:C3 H7OH |
D.CO( NH2)2的电子式: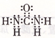 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1molNa2CO3晶体中含CO32ˉ离子数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2L |
| D.0.1mol的CaO2中含阴离子数是0.2NA |
正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
| A.乙烯的结构简式为CH2CH2 | B.乙醇的结构简式为C2H6O |
| C.丙烷的实验式为 C3H8 | D.羟基的电子式: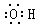 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B.常温常压下,22.4L CH4含有4NA个C—H共价键 |
| C.2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D.10L pH=1的硫酸溶液中含有的H+离子数为2NA |
镁铝合金6.3 g完全溶于稀硝酸,若反应中硝酸被还原只产生4.48L(标准状况下)NO气体,在反应后的溶液中,加入足量Imol.L-I的NaOH溶液,生成沉淀的质量为
| A.8.7 g | B.7.8 g | C.16.5 g | D.4.0g |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1mol Cl2溶于足量水中转移电子数为NA |
| B.在熔融状态下,1molKHSO4完全电离出的阳离子数为2NA |
| C.标准状况下,22.4LNO与CO2的混合气体中含有的原子数为2NA |
| D.CaC2含有的π键的数目为0.2NA |
下列化学用语正确的是 ( )
| A.1,2—二溴乙烷的结构简式:C2 H4 Br2 |
| B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 |
| D.乙烯分子的最简式:CH2 |