题目内容
下列叙述正确的是
| A.标准状况下,2.24LNH3中含有6.02×1022个N—H共价键 |
| B.100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C.将4gNaOH溶于100g蒸溜水,所得溶液物质的量浓度是1.0mol/L |
| D.将7.8gNa2O2放入足量的水中,反应时转移6.02×1022个电子 |
D
解析试题分析:由于n=V/Vm,标准状况下气体摩尔体积为22.4L/mol,则氨气的物质的量为0.1mol,由于阿伏加德罗常数为6.02×1023mol—1,则0.1mol氨气含有6.02×1022个氨气分子,由于每个氨气分子含有3个N—H键,则0.1mol氨气含有3×6.02×1022个N—H键,故A选项错误;由于n=c?V,则碳酸钠的物质的量为0.1mol,由于Na2CO3=2Na++CO32—中碳酸根离子与碳酸钠的系数之比等于物质的量之比,则0.1mol碳酸钠含有0.1mol碳酸根离子,由于碳酸根离子部分水解,则溶液中碳酸根离子小于0.1mol或者小于6.02×1022个,故B选项错误;氢氧化钠的式量为40,n=m/M,则氢氧化钠的物质的量为0.1mol,虽然可以由n/V求c,但是水的体积不等于溶液的体积,所以溶液的体积不一定是0.1L,所得溶液的物质的量浓度不一定是1.0mol/L,故C选项错误;过氧化钠的式量为78,n=m/M,则过氧化钠的物质的量为0.1mol,由于2Na2O2+2H2O=4NaOH+O2↑~2e—,其中转移电子与过氧化钠的系数之比等于物质的量,则该反应中转移电子的物质的量为0.1mol,反应时转移6.02×1022个电子,故D选项正确。
考点:考查阿伏加德罗常数,涉及质量、摩尔质量、物质的量、物质的组成、物质的结构、溶液体积、物质的量浓度、盐类水解、气体体积、气体摩尔体积、物质的量、氧化还原反应转移电子数、物质的量在化学或电离方程式中的应用、强电解质等。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案下列有关化学用语表示不正确的是
A.氯离子的结构示意图: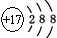 |
B.K2O的电子式: |
C.CO2分子的结构式: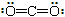 |
D.苯分子的比例模型: |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,22.4L NH3中含有3NA个N-H键 |
| B.1 mol·L-1 CaCl2溶液含有NA个Ca2+ |
| C.48g O3和O2的混合气体中含有3NA个O原子 |
| D.1 molNO2溶于水后溶液中含有NA个NO3- |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1molNa2CO3晶体中含CO32ˉ离子数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2L |
| D.0.1mol的CaO2中含阴离子数是0.2NA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.16g CH4含有10nA个电子 |
| B.常温常压下,22. 4L Cl2含有2nA个Cl原子 |
| C.1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| D.1L 0.1 mol?L-1Na2SO3溶液中含有0. 1nA个SO32- |
正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
| A.乙烯的结构简式为CH2CH2 | B.乙醇的结构简式为C2H6O |
| C.丙烷的实验式为 C3H8 | D.羟基的电子式: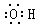 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B.常温常压下,22.4L CH4含有4NA个C—H共价键 |
| C.2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D.10L pH=1的硫酸溶液中含有的H+离子数为2NA |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1mol Cl2溶于足量水中转移电子数为NA |
| B.在熔融状态下,1molKHSO4完全电离出的阳离子数为2NA |
| C.标准状况下,22.4LNO与CO2的混合气体中含有的原子数为2NA |
| D.CaC2含有的π键的数目为0.2NA |
下列有关化学用语使用正确的是( )
A.CO2的电子式: |
B.核内有8个中子的碳原子: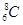 |
C.钾原子结构示意图: |
D.乙烯的比例模型: |