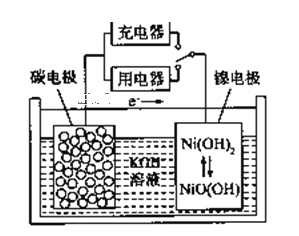
��Ŀ����
����Ŀ������(�Ҷ���)��������Ȼ���ֲ���У���K1=5.4��10��2��K2=5.4��10��5����������κͼ���������ˮ���������������ˮ�����ᾧ��(H2C2O42H2O)��ɫ���۵�Ϊ101�棬������ˮ��������ˮ��������170�����Ϸֽ⡣�ش��������⣺
(1)�����к��еĹ�����������______��
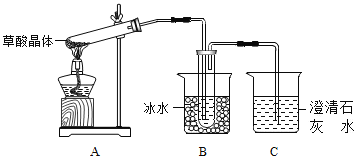
(2)����ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��C�пɹ۲쵽��������______���ɴ˿�֪���ᾧ��ֽ�IJ�������_____��װ��B����Ҫ������_______��
(3)����ͬѧ��Ϊ���ᾧ��ֽ�IJ����к���CO��Ϊ������֤��ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ�IJ���װ��(�����ظ�ѡ��)����ʵ�顣

������ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��B��_____��װ��H��Ӧ����ʢ�е�������_____(�ѧʽ)��
����֤�����ᾧ��ֽ��������CO��������____________��
(4)���ʵ�飺��֤����������Ա�̼���ǿ(�������������������ͬ)______��
���üķ����������ͼ���______��
���𰸡��Ȼ� ������ð���ҳ���ʯ��ˮ����� CO2 ������ˮ�����Ͳ��ᣩ����ֹ�������װ��C��Ӧ���ɳ���������CO2�ļ��� F��D��G��H��D��I CuO H�к�ɫ��ĩ��Ϊ��ɫ������D�г���ʯ��ˮ����� ��ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ��� ��NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2��
��������
(1)����Ϊ�Ҷ��
(2)���������Ϣ�в��ᾧ������ʷ������
(3)��Ҫ��������CO���ڼ���ʵ�����Ũ�������Ƴ�ȥ������̼���ó���ʯ��ˮ���������̼���ü�ʯ�Ҹ���CO������CO�Ļ�ԭ�Խ�CO�����������ó���ʯ��ˮ�������ɵĶ�����̼������ˮ���ռ�CO��Hװ����ʢ�ŵ�����Ӧ�þ��������ԣ��Һ�CO��Ӧ����������������CO���л�ԭ�ԣ������������Ƕ�����̼��������̼��ʹ����ʯ��ˮ����ǣ�
(4)��Ҫ֤���������Դ���̼�ᣬ��������ǿ����ȡ����ڲ���Ϊ��Ԫ���ᣬ����ΪһԪ���ᣬ�ݴ˷������
(1)����Ϊ�Ҷ��ᣬ���еĹ�����Ϊ�Ȼ����ʴ�Ϊ���Ȼ���
(2)���ᾧ��(H2C2O42H2O)��ɫ���۵�Ϊ101����������ˮ��������ˮ��������170�����Ϸֽ⣬����������ȷֽ⣬�ֽ�ʱ�����������̼��������̼���������Ʒ�Ӧ���������Ե�̼��Ƴ�������ʹ����ʯ��ˮ����ǣ�����C�й۲쵽�������ǣ�������ð�����ҳ���ʯ��ˮ����ǣ�˵���ж�����̼���ɣ���������κͼ���������ˮ���������������ˮ�������ӷ����������ɵ������к��в��ᣬ������������Ʒ�Ӧ���������ԵIJ���ƶ����Ŷ�����̼�ļ��飬Bװ���¶Ƚϵͣ����������ã���ֹ���Ŷ�����̼�ļ��飬�ʴ�Ϊ��������ð��������ʯ��ˮ����ǣ�CO2������(ˮ�����Ͳ���)����ֹ�������װ��C��Ӧ���ɳ���������CO2�ļ��飻
(3)��Ҫ�������ɵ�CO���ڼ���ʵ�����Ũ�������Ƴ�ȥ������̼���ó���ʯ��ˮ���������̼���ü�ʯ�Ҹ���CO������CO��CuO������ԭ��Ӧ����CO2�������ó���ʯ��ˮ�������ɵĶ�����̼������ˮ���ռ�CO�������Ⱦ������������˳����A��B��F��D��G��H��D��I��Hװ����ʢ�ŵ�����Ӧ�þ��������ԣ��Һ�CO��Ӧ��������������CuO�ܱ�CO��ԭ�ҷ�Ӧ�����к�ɫ�����Ϊ��ɫ���������ԣ�����H��ʢ�ŵ�������CuO���ʴ�Ϊ��F��D��G��H��D��I��CuO��
��CO���л�ԭ�ԣ������������Ƕ�����̼��������̼��ʹ����ʯ��ˮ����ǣ���CO����ɫ��CuO��ԭΪ��ɫ��Cu��ֻҪH�к�ɫ����ת��Ϊ��ɫ������Dװ����Һ����Ǿ�˵������CO���ʴ�Ϊ��H�к�ɫ��ĩ��Ϊ��ɫ������D�г���ʯ��ˮ����ǣ�
(4)��Ҫ֤���������Դ���̼�ᣬ��������ǿ����ȡ���ᣬ��ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ�����˵���������Դ���̼�ᣬ�ʴ�Ϊ����ʢ������NaHCO3���Թ���μӲ�����Һ�������ݲ�����
�ڲ���Ϊ��Ԫ���ᣬ����ΪһԪ���ᣬ��ͬ���ʵ����������ᣬ�������ĵ���������Ϊ�����2������˿�����NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2�����ʴ�Ϊ����NaOH����Һ�ζ�������Һ������NaOH�����ʵ����Dz����2����

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�����Ŀ����������ʵ���������ý�������ȷ����
ʵ�� | ʵ������ |
| ��Ʒ����Һ��ɫ��ȥ����������Һ�к���SO42- �ڼ�����ɫ�����Һ�����ڣ�δ����ɫ�ָ����������������ʹ��ɫʯ����ֽ��죬�����۵⻯����ֽ�������Ա仯�� |
A. Ʒ����Һ��ɫ����ˮƯ������
B. ����ƿ�з����˷�Ӧ��Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. ��������ڿ�ȷ������������ΪSO2
D. ����SO42-���Լ�Ϊ�����ᡢBaCl2��Һ