题目内容
14.一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )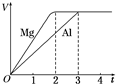
| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:1 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为3:2 |
分析 镁和铝分别与等浓度、等体积稀硫酸反应,化学方程式为:Mg+H2SO4=MgSO4+H2↑; 2Al+3H2SO4=Al2(SO4)3+3H2↑;根据图象生成氢气的质量相等,则消耗的硫酸质量一定相等,因此可能是硫酸对于两种金属都不足,也可能是一种金属恰好完全反应,一种金属剩余.
解答 解:镁和铝分别与等浓度、等体积的稀硫酸反应,化学方程式为:Mg+H2SO4=MgSO4+H2↑; 2Al+3H2SO4=Al2(SO4)3+3H2↑;
A、氢气的V相等,则质量等,根据化学方程式可求镁与铝的质量之比为24:18=4:3,物质的量之比是3:2,故A正确;
B、镁和铝转移电子数之比为2:($\frac{18}{27}×3$)=1:1,故B正确;
C、镁和铝的摩尔质量之比为24:27=8:9,故C正确;
D、镁这条线斜率大,显然镁反应速率快,则反应速率之比为2:3,所用时间之比为2:3,故D错误.
故选D.
点评 本题主要考查了金属的有关的化学性质及根据化学方程式进行有关的计算.难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于化学键的说法正确的是( )
| A. | 离子化合物中一定存在离子键,可能存在共价键 | |
| B. | 由金属元素和非金属元素组的化学键一定是离子键 | |
| C. | 非极性键只存在于双原子单质分子中 | |
| D. | NH4Cl是一种共价化合物 |
9.关于金属的下列说法错误的是( )
| A. | 钠在空气中燃烧时,先熔化,再燃烧,最后所得产物为Na2O2 | |
| B. | 一定条件下,铁粉可与水蒸气反应 | |
| C. | 铝因在空气中形成的一薄层致密氧化膜对铝有保护作用,使得性质比较活泼的金属铝成为一种应用广泛的金属材料 | |
| D. | 铝与氢氧化钠溶液反应,氢氧化钠和水都是氧化剂 |
19.下列有关钠的叙述,正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠有强还原性
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠可以保存在煤油中
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价.
①钠在空气中燃烧生成氧化钠
②金属钠有强还原性
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠可以保存在煤油中
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价.
| A. | ①②④ | B. | ②③⑤ | C. | ①④⑤ | D. | ②④⑤ |
3.下列除杂质的方法可行的是( )
| A. | 用燃烧法除去CO2中的CO | |
| B. | 粗盐提纯操作的顺序是:溶解、过滤、洗涤、蒸发 | |
| C. | 除去铜粉中的氧化铜,可通入H2,加热 | |
| D. | 除去CaCl2中少量的CaCO3可溶于水后加盐酸 |
4.在烧瓶中充满标准状况下干燥的HCl和N2、O2的混合气,已知其平均相对分子质量为34.8,进行喷泉实验后,理论上所得溶液的物质的量浓度为( )
| A. | 0.022mol•L-1 | B. | 0.045mol•L-1 | C. | 0.8mol•L-1 | D. | 无法计算 |
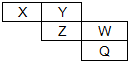 X、Y、Z、W、Q五种元素在周期表中的位置如图所示,已知X、Y、Z、W四种短周期元素的电子数之和是48.回答下列问题:
X、Y、Z、W、Q五种元素在周期表中的位置如图所示,已知X、Y、Z、W四种短周期元素的电子数之和是48.回答下列问题: .
.