题目内容
4.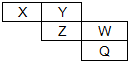 X、Y、Z、W、Q五种元素在周期表中的位置如图所示,已知X、Y、Z、W四种短周期元素的电子数之和是48.回答下列问题:
X、Y、Z、W、Q五种元素在周期表中的位置如图所示,已知X、Y、Z、W四种短周期元素的电子数之和是48.回答下列问题:(1)X、Y、Z、W四种元素的元素符号分别是N、O、S、Cl.
(2)Q在周期表中的位置是第四周期第VIIA族.
(3)X、Y、Z的氢化物中,稳定性最强的氢化物的电子式是
 .
.(4)上述5种元素的气态氢化物中,有一种能与另外4种发生化合反应,实验室制备该物质的化学方程式是
2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(5)能说明W的非金属性比Z强的一个化学方程式是H2S+Cl2=2HCl+S.
(6)W的最高价氧化物的水化物的浓溶液受热可分解,产物之一是只含有非极性键的黄绿色气体,且当有28mol电子转移时,共产生9mol气体,该反应的化学方程式是4HClO4$\frac{\underline{\;\;△\;\;}}{\;}$2Cl2↑+7O2↑+2H2O.
分析 (1)X、Y、Z、W四种短周期元素的电子数之和是48,根据元素在周期表中的位置,设Y元素的原子序数为a,则X原子序数是a-1,Z原子序数为a+8,W原子序数为a+9,a-1+a+a+8+a+9=48,a=8,所以X是N、Y是O、Z是S、W是Cl元素,则Q是Br元素;
(2)Q是Br元素,Q在周期表中的位置是第四周期第VIIA族;
(3)元素的非金属性越强,其氢化物的稳定性越强,这三种元素非金属性强弱顺序是Y>N>S,则稳定性最强的氢化物是水,水分子中每个H原子和O原子之间共用一对电子;
(4)上述5种元素的气态氢化物中,有一种能与另外4种发生化合反应,该氢化物是氨气,实验室用氯化铵和氢氧化钙加热制取氨气;
(5)元素的非金属性越强,其单质的氧化性越强;
(6)W的最高价氧化物的水化物是高氯酸,高氯酸的浓溶液受热可分解,产物之一是只含有非极性键的黄绿色气体为Cl2,且当有28mol电子转移时,共产生9mol气体,转移28mol电子生成n(Cl2)=$\frac{28mol}{14}$=2mol,则生成另一种气体物质的量是7mol,高氯酸中只有O元素能失电子生成氧气,所以生成氧气物质的量是7mol,再结合原子守恒配平方程式.
解答 解:(1)X、Y、Z、W四种短周期元素的电子数之和是48,根据元素在周期表中的位置,设Y元素的原子序数为a,则X原子序数是a-1,Z原子序数为a+8,W原子序数为a+9,a-1+a+a+8+a+9=48,a=8,所以X是N、Y是O、Z是S、W是Cl元素,则Q是Br元素,所以X、Y、Z、W、Q分别是N、O、S、Cl、Br元素,
故答案为:N、O、S、Cl;
(2)Q是Br元素,Q在周期表中的位置是第四周期第VIIA族,故答案为:第四周期第VIIA族;
(3)元素的非金属性越强,其氢化物的稳定性越强,这三种元素非金属性强弱顺序是Y>N>S,则稳定性最强的氢化物是水,水分子中每个H原子和O原子之间共用一对电子,其电子式为 ,故答案为:
,故答案为: ;
;
(4)上述5种元素的气态氢化物中,有一种能与另外4种发生化合反应,该氢化物是氨气,实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)元素的非金属性越强,其单质的氧化性越强,氯气能氧化硫化氢生成S单质,从而说明Cl元素非金属性强于S元素,反应方程式为H2S+Cl2=2HCl+S,故答案为:H2S+Cl2=2HCl+S;
(6)W的最高价氧化物的水化物是高氯酸,高氯酸的浓溶液受热可分解,产物之一是只含有非极性键的黄绿色气体为Cl2,且当有28mol电子转移时,共产生9mol气体,转移28mol电子生成n(Cl2)=$\frac{28mol}{14}$=2mol,则生成另一种气体物质的量是7mol,高氯酸中只有O元素能失电子生成氧气,所以生成氧气物质的量是7mol,再结合原子守恒配平方程式为4HClO4$\frac{\underline{\;\;△\;\;}}{\;}$2Cl2↑+7O2↑+2H2O,
故答案为:4HClO4$\frac{\underline{\;\;△\;\;}}{\;}$2Cl2↑+7O2↑+2H2O.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及氧化还原反应、元素推断、电子式的书写、气体制备等知识点,正确判断元素、明确物质性质是解本题关键,知道非金属性强弱判断方法,题目难度不大.

| A. | 日常生活中使用高锰酸钾溶液浸泡的泡沫塑料箱保鲜水果与高锰酸钾的化学性质有关 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 酸雨的形成主要是因为化石燃料燃烧排放的废气中含有大量的碳氧化物 | |
| D. | 由PM2.5形成的分散系属于胶体,具备胶体的性质 |
| A. | H2SO4是酸,因为H2SO4在水溶液中能电离产生H+ | |
| B. | 纯碱是碱,因为其水溶液显碱性 | |
| C. | 醋酸是弱电解质,因为醋酸在水溶液中部分电离 | |
| D. | 胆矾(CuSO4•5H2O)是混合物,因为胆矾中有水 |
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
| C | 乙醇与高锰酸钾酸性溶液混合 | 乙醇具有还原性 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 原电池的正极反应式为:O2十2H2O十4e-═4OH- | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
| A. | 试管 | B. | 蒸发皿 | C. | 烧瓶 | D. | 坩埚 |
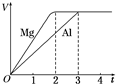
| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:1 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为3:2 |