题目内容
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
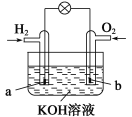
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
【答案】B
【解析】A项,a极通H2为负极,电极反应应为2H2+4OH--4e-===4H2O,发生氧化反应;B项,b极通O2为正极,电极反应为O2+2H2O+4e-===4OH-,B项不正确;C项,正负极电极反应式相加得总反应为2H2+O2===2H2O;D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。

练习册系列答案
相关题目
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
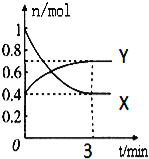
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.