题目内容
【题目】化学己经渗透到人类生活的方方面面。下列说法不正确的是
A. 为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B. 明矾![]() 溶于水会形成胶体,因此可用于自来水的杀菌消毒
溶于水会形成胶体,因此可用于自来水的杀菌消毒
C. 月饼因富含油脂而易发生氧化,保存时常放入装有铁粉的透气袋作抗氧化剂
D. 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
【答案】B
【解析】
A. 醋酸酸性比次氯酸强,醋酸可与次氯酸钙反应生产次氯酸,次氯酸浓度增大,漂白速率增大,故A正确;
B. 明矾中铝离子水解生成胶体,可净化水,不具有强氧化性,不能杀菌消毒,故B错误;
C.铁粉常用作抗氧化剂,故C正确;
D. 维生素C具有还原性,可防止亚铁被氧化,可在口服硫酸亚铁片时同服维生素C,可增强治疗缺铁性贫血效果,故D正确;
故选B。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
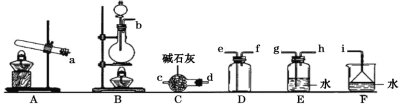
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。