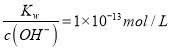题目内容
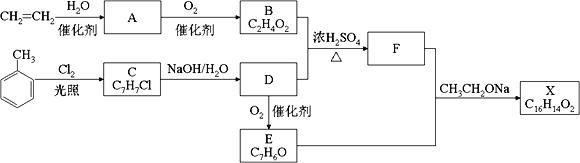
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
【答案】 羟基 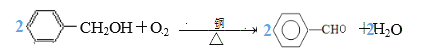
![]() 20
20 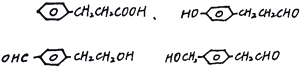
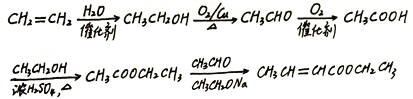
【解析】乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是乙醇,乙醇催化氧化最终生成乙酸,故B是乙酸;甲苯在光照条件下与氯气发生的是取代反应,则D为醇,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′![]() RCH=CHCOOR′,那么E应为醛类,即甲苯与氯气发生的是甲基上的取代,那么C为
RCH=CHCOOR′,那么E应为醛类,即甲苯与氯气发生的是甲基上的取代,那么C为![]() ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为![]() ,即E为
,即E为![]() ,据此推断得出F为:
,据此推断得出F为:![]() ,那么X为
,那么X为![]() ;据以上分析解题。
;据以上分析解题。
(1)据以上分析可知,A为乙醇,官能团的名称是羟基;正确答案:羟基。
(2) D应为![]() ,E为
,E为![]() ,D→E发生醇的催化氧化,化学方程式:
,D→E发生醇的催化氧化,化学方程式: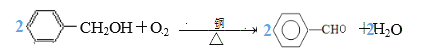 ;正确答案:
;正确答案: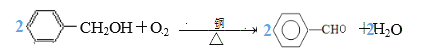 。
。
(3) E为![]() ,F为:
,F为:![]() ,根据信息可知X为
,根据信息可知X为![]() ;正确答案:
;正确答案: ![]() 。
。
(4)F为:![]() ,与F互为同分异构体又满足下列条件的为①遇到氯化铁溶液会显紫色,一定含有酚羟基;②会发生银镜反应,含有醛基;③苯环上有三个取代基;所以苯环上分别连有-OH 、-CHO、–CH2CH3 的结构有10种;苯环上分别连有-OH、 -CH2-CHO、-CH3的结构有10种,共计有20种;在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构可能有羧酸类(环上一个取代基且含有羧基)、醛类(环上有2个取代基,含有醛基、羟基),共有4种结构如下:
,与F互为同分异构体又满足下列条件的为①遇到氯化铁溶液会显紫色,一定含有酚羟基;②会发生银镜反应,含有醛基;③苯环上有三个取代基;所以苯环上分别连有-OH 、-CHO、–CH2CH3 的结构有10种;苯环上分别连有-OH、 -CH2-CHO、-CH3的结构有10种,共计有20种;在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构可能有羧酸类(环上一个取代基且含有羧基)、醛类(环上有2个取代基,含有醛基、羟基),共有4种结构如下:![]()
![]() ;正确答案:20;
;正确答案:20;![]()
![]() 。
。
(5)乙烯水化制乙醇,乙醇氧化制乙醛,最终氧化为乙酸,乙酸和乙醇生成乙酸乙酯,根据信息RCHO+CH![]() RCH=CHCOOR’ 可知,乙酸乙酯与乙醛发生反应生成CH3CH=CHCOOCH2CH3;合成流程如下:
RCH=CHCOOR’ 可知,乙酸乙酯与乙醛发生反应生成CH3CH=CHCOOCH2CH3;合成流程如下: ;正确答案:
;正确答案: 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】(题文)汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1)写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则c(NH4+)/c(SO42-)值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量SO2气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
【题目】下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
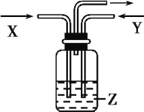
X | Y | Z | |
A | NO2 | SO2 | BaCl2 |
B | NH3 | O2 | Al2(SO4)3 |
C | NH3 | CO2 | CaCl2 |
D | CO2 | SO2 | CaCl2 |
A. A B. B C. C D. D
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
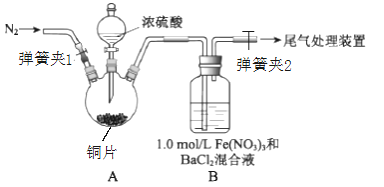
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |