题目内容
【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
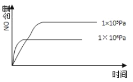
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。

(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________。
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
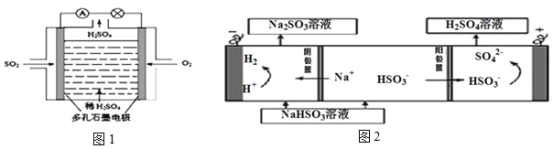
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
【答案】③④ ![]() 压缩体积或增大压强 O2+4e-+4H+=2H2O HSO3-+H2O-2e-=SO42-+3H+ 从氧化还原反应角度分析,SO2中S元素化合价为+4,Na2S2O3中S元素化合价为+2,S的化合价降低,加入合适的还原剂如S等就能实现转化 S2O32-+H2O
压缩体积或增大压强 O2+4e-+4H+=2H2O HSO3-+H2O-2e-=SO42-+3H+ 从氧化还原反应角度分析,SO2中S元素化合价为+4,Na2S2O3中S元素化合价为+2,S的化合价降低,加入合适的还原剂如S等就能实现转化 S2O32-+H2O![]() HS2O3-+OH- S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
HS2O3-+OH- S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
【解析】
(1)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(2)该反应的平衡常数K= ,利用物质反应转化关系将A点时各物质的平衡浓度代入表达式中可得;
,利用物质反应转化关系将A点时各物质的平衡浓度代入表达式中可得;
(3)影响反应速率的因素有温度、浓度、压强和催化剂,影响平衡移动的因素有温度、浓度和压强,提高CO转化率,应使平衡正向移动;
II.(4)依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
(5)根据化合价变化判断阳极反应物质,写出阳极反应式;
III.(6)分析SO2和Na2S2O3中S元素化合价变化情况,结合氧化还原反应原理解答;
(7)Na2S2O3是强碱弱酸盐,水解显碱性;
(8)验证Na2S2O3具有还原性,通过观察新制氯水的变色情况验证。
I.(1)①2v逆(CO)=v正(H2)说明反应达到平衡状态,但v逆(CO)=2v正(H2)v说明反应逆向进行,①错误;
②c(CO)=c(CH3OH)时反应可能处于平衡状态,也可能未处于平衡状态,不能说明正、逆反应速率关系,不能据此判断反应是否处于平衡状态,②错误;
③该反应是气体体积不相等的反应,所以混合气体的平均相对分子质量不变,说明气体的总物质的量不变,反应达到平衡状态,③正确;
④单位时间内生成2n mol H2的同时生成n mol CH3OH,说明v逆(H2)=2v正(CH3OH),说明反应达到平衡状态,④正确;
故合理选项是③④;
(2)对于反应CO+2H2![]() CH3OH(g),反应开始时n(CO)=a mol,n(H2)=2a mol,A点达到平衡时CO转化率为75%,则反应的CO的物质的量为a mol×75%=0.75a mol,反应的H2的物质的量是0.75a mol×2=1.5a mol,反应产生CH3OH的物质的量为0.75a mol,则平衡时各种气体的物质的量为n(CO)=a mol-0.75a mol=0.25a mol,n(H2)=2a mol-1.5a mol=0.5a mol,n(CH3OH)=0.75amol,由于容器的容积为V L,所以在该条件下,反应的化学平衡常数K=
CH3OH(g),反应开始时n(CO)=a mol,n(H2)=2a mol,A点达到平衡时CO转化率为75%,则反应的CO的物质的量为a mol×75%=0.75a mol,反应的H2的物质的量是0.75a mol×2=1.5a mol,反应产生CH3OH的物质的量为0.75a mol,则平衡时各种气体的物质的量为n(CO)=a mol-0.75a mol=0.25a mol,n(H2)=2a mol-1.5a mol=0.5a mol,n(CH3OH)=0.75amol,由于容器的容积为V L,所以在该条件下,反应的化学平衡常数K=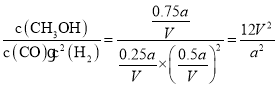 ;
;
(3)既能增大v(CO)又能提高CO转化率,应使平衡正向移动,由于正反应放热,则应采取压缩容器的体积或增大压强的方法;
II.(4)该原电池中,负极上SO2失电子被氧化生成硫酸,正极上O2得到电子被还原,与溶液中的H+结合生成H2O,所以正极上的电极反应式为O2+4e-+4H+=2H2O;
(5)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
III.(6)SO2→Na2S2O3中S元素化合价由+4→+2,化合价降低,根据氧化还原反应规律可知:加入还原性的物质如S或Na2S等,就能实现SO2→Na2S2O3的转化;
(7)Na2S2O3是强碱弱酸盐,S2O32-水解消耗水电离产生的H+,最终达到平衡时溶液中c(OH-)>c(H+),所以溶液显碱性,H2S2O3是二元弱酸,所以S2O32-水解分步进行,但以第一步为主,水解的离子方程式为S2O32-+H2O![]() HS2O3-+OH-;
HS2O3-+OH-;
(8)新制氯水的主要成分为Cl2,Cl2氧化S2O32-生成SO42-,Cl2得到电子被还原为Cl-,使氯水颜色变浅,甚至褪去,所以离子方程式为S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-。

 口算能手系列答案
口算能手系列答案【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
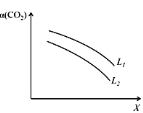
①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。