题目内容
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:

已知:①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3kJmol-1
SO2Cl2(l) △H=-97.3kJmol-1
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_________。
(2)仪器b的名称为_________。
(3)装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为___。当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率 _________。为提高硫酰氯的产率,本实验操作中还需要注意的事项有___(只答一条即可)。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________,分离两种产物的方法是_________。
(5)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应。_________(简要描述实验步骤、现象和结论)。仪器自选;供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
(6)长期存放的硫酰氰会发黄,其原因可能为_________。
【答案】平衡分液漏斗内外气压,便于液体顺利流下 冷凝管 饱和食盐水 80% 控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等 2C1SO3H![]() SO2Cl2+H2SO4 蒸馏 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应 溶解硫酰氯分解生成的氯气
SO2Cl2+H2SO4 蒸馏 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应 溶解硫酰氯分解生成的氯气
【解析】
将恒压分液漏斗中的硫酸滴入烧瓶中,发生复分解反应产生SO2气体,在装置B中经浓硫酸干燥后,进入装置C;将分液漏斗中的饱和NaCl溶液滴入装置E,将E中的Cl2经装置D中浓硫酸干燥后进入装置C,在装置C中SO2、Cl2发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(l),合成硫酰氯,然后根据物质的性质、仪器的结构等逐一分析解答。
SO2Cl2(l),合成硫酰氯,然后根据物质的性质、仪器的结构等逐一分析解答。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是可以平衡分液漏斗内外气压,便于液体顺利流下;
(2)由仪器b的结构特征,可知b为冷凝管;
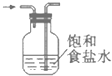
(3)利用分液漏斗中的液体将装置E的氯气排出,与二氧化硫在装置C中反应,为了降低Cl2的溶解度,可根据Cl2与水的反应是可逆反应的特点,在分液漏斗盛装饱和食盐水;11.2 L标准状况下的氯气的物质的量n(Cl2)=![]() =0.05 mol,根据反应方程式可知反应产生的硫酰氯的物质的量为n(SO2Cl2)= n(Cl2)=0.05 mol,故理论上生成SO2Cl2的质量m(SO2Cl2)=0.05 mol×135 g/mol=6.75 g,所以其产率为
=0.05 mol,根据反应方程式可知反应产生的硫酰氯的物质的量为n(SO2Cl2)= n(Cl2)=0.05 mol,故理论上生成SO2Cl2的质量m(SO2Cl2)=0.05 mol×135 g/mol=6.75 g,所以其产率为![]() ×100%=80%;该反应的正反应是气体体积减小的放热反应,为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温;
×100%=80%;该反应的正反应是气体体积减小的放热反应,为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温;
(4)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,反应方程式为:2C1SO3H![]() SO2Cl2+H2SO4;二者为互溶的液体物质,沸点相差较大,可采取蒸馏法进行分离;
SO2Cl2+H2SO4;二者为互溶的液体物质,沸点相差较大,可采取蒸馏法进行分离;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,反应方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,反应产生的硫酸和盐酸不具有漂白性,所以不能使品红溶液褪色,所以检验二者是否恰好完全反应方案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应;
(6)100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气,氯气为黄绿色气体,可能是溶解氯气所致。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。

(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________。
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
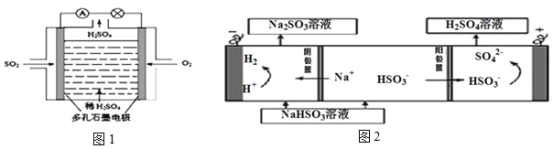
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数