题目内容
【题目】氮的化合物在生产生活中广泛存在。
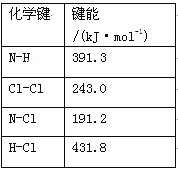
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
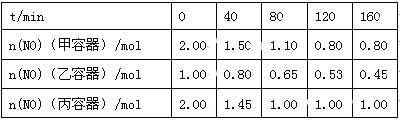
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
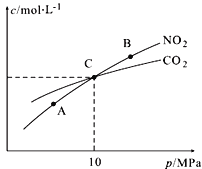
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】(1)①![]() (2分);+11.3 kJmol-1
(2分);+11.3 kJmol-1
②NH2Cl+H2O![]() NH3+HClO
NH3+HClO
(2)①放热;
②0.003 molL-1min-1
(3)①=
②A
③2 MPa
【解析】
试题分析:(1)①氯胺(NH2Cl)为共价化合物,电子式为:![]() ;制备氯胺的反应为:NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),根据化学反应的焓变等于反应物键能总和减去生成物键能总和可知:该反应的ΔH=(391.3×3+243.0) kJ·mol-1-(391.3×2+191.2+431.8) kJ·mol-1=+11.3 kJmol-1。
;制备氯胺的反应为:NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),根据化学反应的焓变等于反应物键能总和减去生成物键能总和可知:该反应的ΔH=(391.3×3+243.0) kJ·mol-1-(391.3×2+191.2+431.8) kJ·mol-1=+11.3 kJmol-1。
故答案为:![]() ;+11.3 kJmol-1;
;+11.3 kJmol-1;
②根据题意可知NH2Cl与水反应生成强氧化性的物质HClO,可作长效缓释消毒剂,所以该反应的化学方程式为:NH2Cl+H2O![]() NH3+HClO。
NH3+HClO。
故答案为:NH2Cl+H2O![]() NH3+HClO;
NH3+HClO;
(2)①依据表中数据可知,该反应在T℃时反应速率快,达到平衡状态时n(NO)减小。则T>400,且随着温度升高,平衡向逆反应方向移动,说明该反应为放热反应。
故答案为:放热;
②根据2NO(g)+C(s)![]() N2(g)+CO2(g)可知,该反应过程中压强不变,甲、乙两容器到达平衡状态为等效平衡。所以乙容器在200min达到平衡状态时n(NO)=0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=
N2(g)+CO2(g)可知,该反应过程中压强不变,甲、乙两容器到达平衡状态为等效平衡。所以乙容器在200min达到平衡状态时n(NO)=0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=![]() = 0.003molL-1min-1。
= 0.003molL-1min-1。
故答案为:0.003 molL-1min-1
(3)①反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g)在恒温条件下进行,化学平衡常数只与温度有关,所以Kc(A) = Kc(B).
N2(g)+2CO2(g)在恒温条件下进行,化学平衡常数只与温度有关,所以Kc(A) = Kc(B).
故答案为:=;
②A、B、C三点中达到平衡状态后A点NO2浓度最小,所以NO2的转化率最高。
故答案为:A;
③由焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=
=4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=![]() =2MPa。
=2MPa。
故答案为:2MPa。

 名校课堂系列答案
名校课堂系列答案