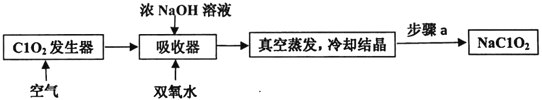
��Ŀ����
����Ŀ�����仯������������;��������ʵ������������±���ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | 85.5 | 115.2 | >600���ֽ⣩ | 75.5 | 16.8 | 10.3 |
�е�/�� | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Oԭ�ӵĵ����Ų�ͼΪ_______����̬Oԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____�Σ�Oԭ���������ӵ��˶�״̬��_____�֡�
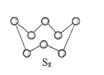
��2����ͼΪS8�Ľṹ���÷�����Sԭ�ӵ��ӻ��������Ϊ______________�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ_____________��
��3����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ_____�Σ��������������д�������ͼ��ʾ�����۷��ӣ��÷�����Sԭ�ӵļ۲������___________��
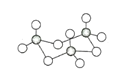
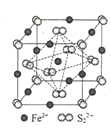
��4��FeS2����ľ�����ͼ��ʾ����������Fe2+_____������S22-_____����������Fe2+λ��S22-���γɵ�____(���϶����)�����ġ������߳�Ϊa nm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ___________gcm��3��
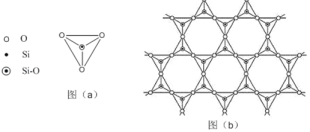
��5���ڹ������У�SiO44�������壨����ͼ��a��ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼ��b��Ϊһ��������״�ṹ�Ķ�����������Siԭ�ӵ��ӻ���ʽΪ____���ö������Ļ�ѧʽΪ_____��
���𰸡�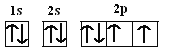 ���壨�Ĵ��� 6 sp3 S8��Է����������Ӽ䷶�»���ǿ ƽ�������� 4 4 4 ��������
���壨�Ĵ��� 6 sp3 S8��Է����������Ӽ䷶�»���ǿ ƽ�������� 4 4 4 �������� ![]() ��1021 sp3 Si2O5��n2n-
��1021 sp3 Si2O5��n2n-
��������
��1������O��̬ԭ�ӵĺ�������Ų�ʽ���
��2���Ƚ��ͼ�ijɼ���Ŀ���µ��Ӷ���Ŀ�ж����ӻ����ͣ��ٸ���Ӱ��S8���Ӿ����۷е�ߵ͵��Ƿ��»����жϣ�
��3�����ݼ۲���ӶԻ������۷�����
��4�����þ�̯���Ծ����е����Ӹ������з������ٸ���![]() ���м��㣻
���м��㣻
��5������ͼ�еļ��ι�ϵ���з�����
��1����̬Oԭ�ӵĵ����Ų�ʽΪ1s22s22p4�����������ӵĵ����Ų�ͼΪ��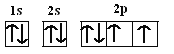 �����ݵ����Ų�ʽ��֪������ռ������ܼ�Ϊ2p�������������ͼΪ���壨�Ĵ����Σ���ͬ�ĵ����˶�״̬������ͬ����Oԭ���������6�����ӣ�����ӵ��˶�״̬��6�֣��ʴ�Ϊ��
�����ݵ����Ų�ʽ��֪������ռ������ܼ�Ϊ2p�������������ͼΪ���壨�Ĵ����Σ���ͬ�ĵ����˶�״̬������ͬ����Oԭ���������6�����ӣ�����ӵ��˶�״̬��6�֣��ʴ�Ϊ��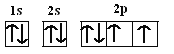 �����壨�Ĵ�����6��
�����壨�Ĵ�����6��
��2��S8��SO2�γɵľ����Ϊ���Ӿ��壬����ͼ���Կ�����S��Χ������Sԭ�ӳɼ���Sԭ�ӻ���2���µ��Ӷԣ�����ӻ�������ۿ�֪���÷�����Sԭ�ӵ��ӻ��������Ϊsp3������������û�������������ʵ��۷е���Ҫ����Է���������Ӱ�죬��ΪS8����Է����������Ӽ䷶�»���ǿ������S8���۷е����SO2���ʴ�Ϊ��sp3��S8��Է����������Ӽ䷶�»���ǿ��
��3����VSEPR���ۣ�SO3��������Ϊ3���µ��Ӷ���Ϊ![]() =0����SO3�ķ��ӹ���Ϊƽ���������Σ��ӻ���ʽΪsp2�ӻ����������������д�����ͼ��ʾ�����۷��ӣ��÷���Sԭ���γ�4�����ۼ������Sԭ�ӵļ۲������Ϊ4���ʴ�Ϊ��ƽ�������ǣ�4��
=0����SO3�ķ��ӹ���Ϊƽ���������Σ��ӻ���ʽΪsp2�ӻ����������������д�����ͼ��ʾ�����۷��ӣ��÷���Sԭ���γ�4�����ۼ������Sԭ�ӵļ۲������Ϊ4���ʴ�Ϊ��ƽ�������ǣ�4��
��4�����ݾ����ṹ��֪�����������ӵĸ���Ϊ![]() ��12+1=4����������Ӹ���Ϊ8��
��12+1=4����������Ӹ���Ϊ8��![]() +6��
+6��![]() =4��������Fe2+λ��S22-���γɵ�������������ġ������߳�Ϊanm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA�������ܶȵļ������ʽΪ��
=4��������Fe2+λ��S22-���γɵ�������������ġ������߳�Ϊanm��FeS2��Է�������ΪM�������ӵ�������ֵΪNA�������ܶȵļ������ʽΪ��![]() ���ʴ�Ϊ��4��4���������壬
���ʴ�Ϊ��4��4���������壬![]() ��1021��
��1021��
��5���������еĹ������SiO44����Ϊ������ṹ��ÿ��Siԭ����Χ����4��Oԭ���������¶Ե��ӣ���������ԭ��Siԭ�Ӳ�ȡ��sp3�ӻ������ݾ����ṹͼ��֪��ͼb�ö���������С�Ľṹ��ԪΪ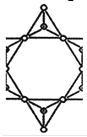 ���ýṹ��Ԫ�к���1+2��
���ýṹ��Ԫ�к���1+2��![]() =2��Siԭ�ӣ�1+1+6��
=2��Siԭ�ӣ�1+1+6��![]() =5��Oԭ�ӣ������������ϼ۵Ĵ�����Ϊ���������������ÿ��������Si-O�е�Oԭ�Ӵ�һ����λ�ĸ���ɣ����Ըö������Ļ�ѧʽΪ(Si2O5��n2n-���ʴ�Ϊ��. sp
=5��Oԭ�ӣ������������ϼ۵Ĵ�����Ϊ���������������ÿ��������Si-O�е�Oԭ�Ӵ�һ����λ�ĸ���ɣ����Ըö������Ļ�ѧʽΪ(Si2O5��n2n-���ʴ�Ϊ��. sp