题目内容
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是
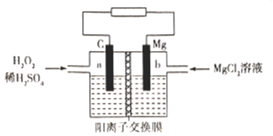
A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
【答案】B
【解析】
由镁-过氧化氢燃料电池的反应方程式Mg + H2O2 + H2SO4=MgSO4+ 2H2O,结合图示可知,a极为正极,发生还原反应,b极为负极。
A.a极为正极,发生还原反应,a极的电极方程式为 H2O2 +2e-+2H+=2H2O,A正确;
B.电子由负极沿导线流向正极,即电子由b极沿导线流向a极,电子不能通过电解质溶液,B错误;
C.在原电池中,阳离子移向正极,Mg2+由右侧经过阳离子交换膜移向左侧,C正确;
D. b极为负极,电极反应式为Mg-2e-=Mg2+,D正确;
答案选B。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目