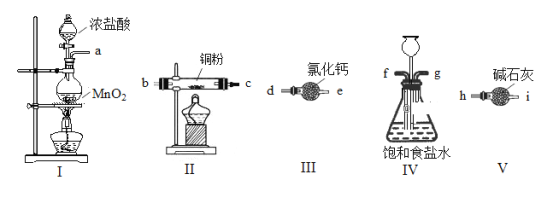
题目内容
【题目】向体积为2![]() 的容器中加入1
的容器中加入1![]() N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),2
2NH3(g),2![]() 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:
(1)2![]() 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
【答案】1.2 0.8 0.1 0.2
【解析】
依据化学平衡的三段式列式计算得到2min后的物质的量,从而计算H2、NH3的物质的量的变化量,根据v=![]() 计算v(N2)和v(NH3)。
计算v(N2)和v(NH3)。
向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
起始量(mol) 1 6 0
变化量(mol) 0.4 1.2 0.8
2![]() (mol) 0.6 4.4 0.8
(mol) 0.6 4.4 0.8
(1)2min内,H2的物质的量减少了1.2mol,NH3的物质的量增加了0.8mol;
(2)用N2的浓度变化来表示该反应的反应速率v(N2)=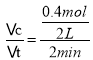 =0.1 mol/(L·min);
=0.1 mol/(L·min);
(3)用NH3的浓度变化来表示该反应的反应速率v(NH3)=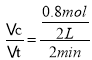 =0.2 mol/(L·min)。
=0.2 mol/(L·min)。

【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
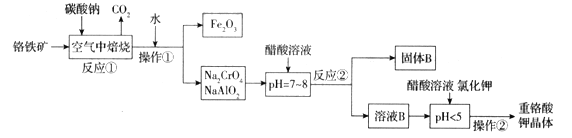
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。