��Ŀ����
����A��B��C��D��E��F���ֳ����Ķ�����Ԫ�أ�ԭ���������ε�����A��ԭ�Ӱ뾶������Ԫ������С�ģ�B��C��DΪ��2�������ڵ�����Ԫ�أ���ԭ�Ӱ뾶B��C��D��F�ǵ�3����Ԫ�أ�����������Ϊ6��C��Fͬ���壬E��Aͬ���壮��ش�
��1��д��Ԫ��A��Ԫ�����ڱ��е�λ�� ��
��2��C��E���γ����ӻ�����E2C����д�����ĵ���ʽ ��
��3��B������������ˮ��������B���⻯�ﷴӦ�����������ʣ��仯ѧ��Ӧ����ʽ�� ��
��4��F�ĵͼ���������C��ijһ���⻯���������ԭ��Ӧ���仯ѧ��Ӧ����ʽ�� ��
��5��D��F�ĵ���һ�������·�Ӧ����FD6����������һ���˹��ϳɵĶ������壬�����������ٺ˼ƻ����ֹ㷺Ӧ���ڵ�����ҵ����FD6�γɾ���ʱ���侧������Ϊ ��
��6����1L���ܱ������У�ͨ��1mol B2�����3mol A2���壬һ���¶��·�Ӧ����BA3���壬����Ӧ�ﵽƽ��ʱ��B2��Ũ��Ϊ0.75mol��L-1��ͬʱ�ų�Լ23.1kJ���������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1��д��Ԫ��A��Ԫ�����ڱ��е�λ��
��2��C��E���γ����ӻ�����E2C����д�����ĵ���ʽ
��3��B������������ˮ��������B���⻯�ﷴӦ�����������ʣ��仯ѧ��Ӧ����ʽ��
��4��F�ĵͼ���������C��ijһ���⻯���������ԭ��Ӧ���仯ѧ��Ӧ����ʽ��
��5��D��F�ĵ���һ�������·�Ӧ����FD6����������һ���˹��ϳɵĶ������壬�����������ٺ˼ƻ����ֹ㷺Ӧ���ڵ�����ҵ����FD6�γɾ���ʱ���侧������Ϊ
��6����1L���ܱ������У�ͨ��1mol B2�����3mol A2���壬һ���¶��·�Ӧ����BA3���壬����Ӧ�ﵽƽ��ʱ��B2��Ũ��Ϊ0.75mol��L-1��ͬʱ�ų�Լ23.1kJ���������÷�Ӧ���Ȼ�ѧ����ʽ��
������A��B��C��D��E��F���ֳ����Ķ�����Ԫ�أ�ԭ���������ε�����A��ԭ�Ӱ뾶������Ԫ������С�ģ���AΪHԪ�أ�F�ǵ�3����Ԫ�أ�����������Ϊ6����FΪSԪ�أ�C��Fͬ���壬��CΪOԪ�أ�B��C��DΪ��2�������ڵ�����Ԫ�أ���ԭ�Ӱ뾶B��C��D������֪BΪNԪ�ء�DΪFԪ�أ�E��Aͬ���壬���ԭ��������֪EΪNa���ݴ˽��
����⣺A��B��C��D��E��F���ֳ����Ķ�����Ԫ�أ�ԭ���������ε�����A��ԭ�Ӱ뾶������Ԫ������С�ģ���AΪHԪ�أ�F�ǵ�3����Ԫ�أ�����������Ϊ6����FΪSԪ�أ�C��Fͬ���壬��CΪOԪ�أ�B��C��DΪ��2�������ڵ�����Ԫ�أ���ԭ�Ӱ뾶B��C��D������֪BΪNԪ�ء�DΪFԪ�أ�E��Aͬ���壬���ԭ��������֪EΪNa��
��1��AΪHԪ�أ����ڵ�һ���ڢ�A�壬�ʴ�Ϊ����һ���ڢ�A�壻
��2��C��E���γ����ӻ�����ΪNa2O�����ĵ���ʽΪ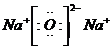 ���ʴ�Ϊ��
���ʴ�Ϊ��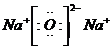 ��
��
��3�����������ᷴӦ��������泥��仯ѧ��Ӧ����ʽ��NH3+HNO3=NH4NO3���ʴ�Ϊ��NH3+HNO3=NH4NO3��
��4��F�ĵͼ�������Ϊ����������C��ijһ���⻯���������ԭ��Ӧ��Ӧ�Ƕ���������������ⷴӦ�������ᣬ��Ӧ����ʽΪ��SO2+H2O2=H2SO4��
�ʴ�Ϊ��SO2+H2O2=H2SO4��
��5��D��F�ĵ���һ�������·�Ӧ����SF6����������һ���˹��ϳɵĶ������壬Ӧ�ɷ��ӹ��ɣ���SF6�γɾ���ʱ�����ڷ��Ӿ��壬
�ʴ�Ϊ�����Ӿ��壻
��6����1L���ܱ������У�ͨ��1mol N2�����3mol H2���壬һ���¶��·�Ӧ����NH3���壬����Ӧ�ﵽƽ��ʱ��N2��Ũ��Ϊ0.75mol��L-1����μӷ�Ӧ�ĵ��������ʵ���=1mol-0.75mol/L��1L=0.25mol��ͬʱ�ų�Լ23.1kJ����������1mol������Ӧ�ų�������=23.1kJ��
=92.4kJ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�N2��g��+3H2��g��=2NH3��g����H=-92.4kJ?mol-1��
�ʴ�Ϊ��N2��g��+3H2��g��=2NH3��g����H=-92.4kJ?mol-1��
��1��AΪHԪ�أ����ڵ�һ���ڢ�A�壬�ʴ�Ϊ����һ���ڢ�A�壻
��2��C��E���γ����ӻ�����ΪNa2O�����ĵ���ʽΪ
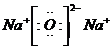 ���ʴ�Ϊ��
���ʴ�Ϊ��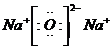 ��
����3�����������ᷴӦ��������泥��仯ѧ��Ӧ����ʽ��NH3+HNO3=NH4NO3���ʴ�Ϊ��NH3+HNO3=NH4NO3��
��4��F�ĵͼ�������Ϊ����������C��ijһ���⻯���������ԭ��Ӧ��Ӧ�Ƕ���������������ⷴӦ�������ᣬ��Ӧ����ʽΪ��SO2+H2O2=H2SO4��
�ʴ�Ϊ��SO2+H2O2=H2SO4��
��5��D��F�ĵ���һ�������·�Ӧ����SF6����������һ���˹��ϳɵĶ������壬Ӧ�ɷ��ӹ��ɣ���SF6�γɾ���ʱ�����ڷ��Ӿ��壬
�ʴ�Ϊ�����Ӿ��壻
��6����1L���ܱ������У�ͨ��1mol N2�����3mol H2���壬һ���¶��·�Ӧ����NH3���壬����Ӧ�ﵽƽ��ʱ��N2��Ũ��Ϊ0.75mol��L-1����μӷ�Ӧ�ĵ��������ʵ���=1mol-0.75mol/L��1L=0.25mol��ͬʱ�ų�Լ23.1kJ����������1mol������Ӧ�ų�������=23.1kJ��
| 1mol |
| 0.25mol |
�ʴ�Ϊ��N2��g��+3H2��g��=2NH3��g����H=-92.4kJ?mol-1��
���������⿼��ṹ����λ�ù�ϵӦ�ã��ѶȲ����ƶ�Ԫ���ǽ���ؼ������س��û�ѧ����飬ע�������Ȼ�ѧ����ʽ����������д��

��ϰ��ϵ�д�
 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
�����Ŀ
 ����A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������D��E���⻯����ӹ��Ͷ���V�ͣ�A��B������������֮����C��������������ȣ�A�ֱܷ���B��C��D�γɵ���������ȵķ��ӣ���A��D���γɵĻ���������¾�ΪҺ̬��
����A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������D��E���⻯����ӹ��Ͷ���V�ͣ�A��B������������֮����C��������������ȣ�A�ֱܷ���B��C��D�γɵ���������ȵķ��ӣ���A��D���γɵĻ���������¾�ΪҺ̬��






